题目内容
【题目】I .光气(COCl2)在塑料、制革、制药等工业上有许多用途。制备光气的方法很多, 下列两种方法常用。
(1)方法一:工业上制备光气的原理:CO+Cl2![]() COCl2,其中原料气CO可利用天然气在氧气中不完全燃烧生产,已知:
COCl2,其中原料气CO可利用天然气在氧气中不完全燃烧生产,已知:
CH4(g)+2O2(g) =CO2(g)+2H2O(1) △H = - 890.3 kJ·mol-1
2CO(g)+O2(g)= 2CO2(g) △H =-566 kJ·mol-1
每生产224LCO (标准状况)所放出的热量约为________ kJ。
(2)方法二:实验室可用氯仿(CHCl3)与双氧水反应制备光气,同时还有一种酸性溶液生成。写出实验室制备光气的化学方程式__________。
II.COCl2 的分解反应为:COCl2(g)![]() Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示(第l0min到14 min的COCl2浓度变化曲线未画出):
Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示(第l0min到14 min的COCl2浓度变化曲线未画出):
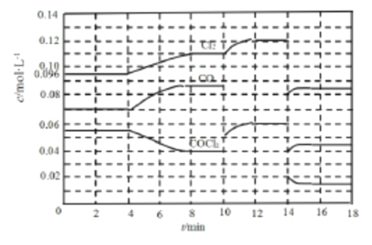
(3)先计算第8 min时CO的浓度,再计算平衡数K=________。
(4)比较第2 min反应温度与第8 min反应温度T8的高低:T2_____T8(选填“ >”、“< ”或“=”)。
(5)若12 min时反应于温度T8下重新达到平衡,则此时c(COCl2)=_____mol·L-1(结果保留两位小数)。
【答案】6073 ![]() (“=”写出“→”也可) 0.231mol/L或0.231 < 0.03
(“=”写出“→”也可) 0.231mol/L或0.231 < 0.03
【解析】
I.(1)已知:①CH4(g)+2O2(g) =CO2(g)+2H2O(1) ![]() =-890.3 kJ·mol-1,
=-890.3 kJ·mol-1,
②2CO(g)+O2(g)= 2CO2(g) ![]() =-566 kJ·mol-1,
=-566 kJ·mol-1,
由盖斯定律可知,①×2-②可得天然气不完全燃烧生成CO的热化学方程式为:![]() ,由热化学方程式可知,每生成标况下224LCO(即10mol),所放出的热量约为:1214.6kJ×5=6073kJ,
,由热化学方程式可知,每生成标况下224LCO(即10mol),所放出的热量约为:1214.6kJ×5=6073kJ,
故答案为:6073;
(2)氯仿中C元素化合价为+2价,双氧水中O元素化合价为-1价,光气中C元素化合价为+4价,根据化合价升降守恒以及原子守恒可知其化学方程式为:![]() ,
,
故答案为:![]() (“=”写出“→”也可)
(“=”写出“→”也可)
II.(3)8min时,c(COCl2)=0.04mol/L,Δc(Cl2)= (0.11-0.096)mol/L=0.014mol/L,则平衡时c(CO)=(0.07+0.014)mol/L=0.084mol/L,平衡常数![]() ,
,
故答案为:0.231mol/L或0.231;
(4)第4min时,反应物浓度逐渐减小,生成物浓度逐渐增加,说明平衡正向移动,该反应正向为吸热反应,升高温度,平衡将向吸热反应方向移动,由此可知,T2<T8,
故答案为:<;
(5)由图可知,10min瞬间Cl2浓度增大,CO浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min达平衡时的平衡常数相同,由图可知,12min时,c(CO)=0.06mol/L,c(Cl2)=0.12mol/L,故:![]() ,解得c(COCl2)=0.03mol/L,
,解得c(COCl2)=0.03mol/L,
故答案为:0.03。

 阅读快车系列答案
阅读快车系列答案
