题目内容
已知热化学方程式:
H2O(g) == H2(g) + O2(g) △H =" +241.8" kJ·mol-1
H2(g)+ O2(g) == H2O(1) △H = -285.8 kJ·mol-1
当1g液态水变为水蒸气时,其热量变化是( )
H2O(g) == H2(g) + O2(g) △H =" +241.8" kJ·mol-1
H2(g)+ O2(g) == H2O(1) △H = -285.8 kJ·mol-1
当1g液态水变为水蒸气时,其热量变化是( )
| A.吸热88kJ | B.吸热2.44 kJ | C.放热44kJ | D.吸热44 kJ |
B
根据盖斯定律可知,两式相加即得到H2O(g)=H2O(1),其反应热是241.8 kJ·mol-1-285.8 kJ·mol-1=-44 kJ·mol-1,即18g气态水生成液态水时,会放出44kJ的能量。则1g液态水变为水蒸气时吸收能量是44kJ÷18=2.44 kJ。答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:  CH4(g)+HC
CH4(g)+HC CH(g)+H2(g) △H1="156.6" kJ·mol-1
CH(g)+H2(g) △H1="156.6" kJ·mol-1 CH2(g)
CH2(g)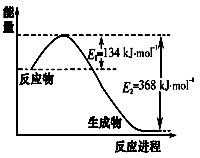
 2NH3(g) △H2=-92.4kJ/mol
2NH3(g) △H2=-92.4kJ/mol 2NH3中,每生成2mol NH3,
2NH3中,每生成2mol NH3,