题目内容
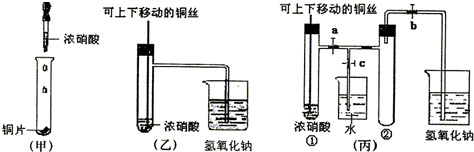
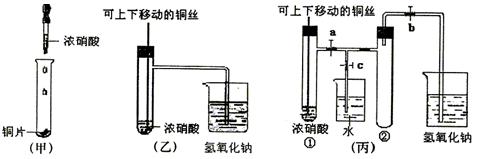
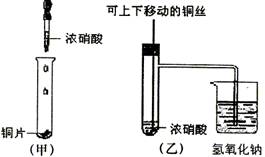
(8分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生改进后的装置:
(1)写出铜和浓硝酸反应的化学方程式 。
(2)和甲装置相比,乙装置的优点 。
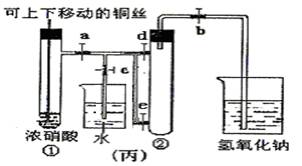
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满②试管。
(4)当气体充满②试管后,欲使烧杯中的水进入②试管应如何操作 。
【答案】
(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O (2分)
(2)①可以控制反应。②吸收NO2气体,防止污染环境。(2分)
(3)关闭c,d;打开a、b,e。(2分)
(4)先关闭b,迅速将铜丝提起与溶液脱离,再关闭a,e, 然后打开c,d,用手捂住②试管(热水、热毛巾、加热)。(合理答案均给分) (2分)
【解析】(1)硝酸具有强氧化性,能把铜氧化生成硝酸铜、NO2和水,方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
(2)乙中铜丝可以上下移动,因此便于控制反应;其次有尾气处理装置,吸收NO2气体,防止污染环境。
(3)NO2的密度大于空气的,所以应该是先关闭弹簧夹c、d,然后再打开弹簧夹a、b、e,才能时NO2气体充满试管②。
(4)欲使烧杯中的水进入②试管,则必须使NO2溶于水降低越强,所以正确的操作是先关闭b,迅速将铜丝提起与溶液脱离,再关闭a,e,然后打开c,d,用手捂住②试管(热水、热毛巾、加热)。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目