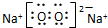题目内容
2.室温下,将pH=3的硫酸溶液和pH=12的氢氧化钠溶液混和,若使混和后溶液的pH=7,则硫酸溶液和氢氧化钠溶液的体积比是( )| A. | 1:20 | B. | 1:10 | C. | 20:1 | D. | 10:1 |
分析 设硫酸的体积为xmL,氢氧化钠的体积为ymL,根据混和后溶液的pH=7,则酸中n(H+)=碱中n(OH-),据此计算.
解答 解:pH=3的硫酸溶液中c(H+)=0.001mol/L,pH=12的氢氧化钠溶液中c(OH-)=0.01mol/L,设硫酸的体积为xmL,氢氧化钠的体积为ymL,混和后溶液的pH=7,则酸中n(H+)=碱中n(OH-),即xmL×0.001mol/L=ymL×10-2mol/L,解得x:y=10:1,故选D.
点评 本题考查pH的计算,酸碱混合的计算为高考高频考点,侧重学生分析问题解决问题能力及计算能力的考查,题目难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
13. 据新华社2009年5月9日电,国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义.请回答下列问题:
据新华社2009年5月9日电,国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义.请回答下列问题:
(1)氢能是理想的清洁能源,也是氢氧燃料电池的必不可少的物质.请回答下列问题.
①下列说法不正确的是C.
A.太阳光催化分解水制氢比电解水制氢更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池负极电极反应相同
D.氢氧燃料电池正极获得8mol电子,负极需要8g气体
②利用MnFe2O4为催化剂,通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4$\frac{\underline{\;>1000K\;}}{\;}$MnFe2O4-X+$\frac{X}{2}$
则第二步反应的化学方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑(条件不写).
③一种新能源汽车,使用了以碳纳米管为储氢介质的燃料电池,电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是D.
A.放电过程中整个体系内KOH浓度不变
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.放电时,电池反应为2H2+O2→2H2O
(2)热值指在一定条件下每克物质完全燃烧所放出的热量(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据.已知:管道煤气(47g/m3H2、625g/m3CO)价格为1.00元/m3,天然气(714g/m3CH4)的价格为2.50元/m3.
①根据以上热值数据,H2是最理想的燃料.
②家庭使用管道煤气和天然气,天然气 更经济合算.
③表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280kJ/mol.
 据新华社2009年5月9日电,国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义.请回答下列问题:
据新华社2009年5月9日电,国务院总理温家宝主持召开国务院常务会议,会上通过了我国2009年将投入大量资金发展新能源汽车,支持节能、环保、安全等关键技术开发,为我国社会经济可持续发展打下良好基础,为今后改善环境、提升民众的生活质量具有极为重要的意义.请回答下列问题:(1)氢能是理想的清洁能源,也是氢氧燃料电池的必不可少的物质.请回答下列问题.
①下列说法不正确的是C.
A.太阳光催化分解水制氢比电解水制氢更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池负极电极反应相同
D.氢氧燃料电池正极获得8mol电子,负极需要8g气体
②利用MnFe2O4为催化剂,通过两步反应使水分解制氢气,第一步反反应为:MnFe2O4$\frac{\underline{\;>1000K\;}}{\;}$MnFe2O4-X+$\frac{X}{2}$
则第二步反应的化学方程式为MnFe2O4-X+xH20=MnFe2O4+xH2↑(条件不写).
③一种新能源汽车,使用了以碳纳米管为储氢介质的燃料电池,电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是D.
A.放电过程中整个体系内KOH浓度不变
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.放电时,电池反应为2H2+O2→2H2O
(2)热值指在一定条件下每克物质完全燃烧所放出的热量(燃烧产物在该条件下是一种较为稳定的状态),下表是几种物质在常温常压下的热值数据.已知:管道煤气(47g/m3H2、625g/m3CO)价格为1.00元/m3,天然气(714g/m3CH4)的价格为2.50元/m3.
| 物质 | H2 | CO | CH4 |
| 热值/kJ•g-1 | 143 | 10 | 56 |
②家庭使用管道煤气和天然气,天然气 更经济合算.
③表示CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280kJ/mol.
10.实验室用需配制250mL0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的Na2CO3溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)B C A F E D;
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确量取所需的碳酸钠的质量,加水(约30mL)溶解
C.将溶解液注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.逐滴加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是将所有碳酸钠移入容量瓶,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作偏低,若加蒸馏水时不慎超过了刻度偏低,若定容时俯视刻度线偏高,称量时游码和物体位置放错偏低,Na2CO3含有少量结晶水偏低.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面重新配制.
(1)配制250mL0.1mol/L的Na2CO3溶液
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确量取所需的碳酸钠的质量,加水(约30mL)溶解
C.将溶解液注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.逐滴加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是将所有碳酸钠移入容量瓶,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作偏低,若加蒸馏水时不慎超过了刻度偏低,若定容时俯视刻度线偏高,称量时游码和物体位置放错偏低,Na2CO3含有少量结晶水偏低.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面重新配制.
17.某元素最高价氧化物对应水化物的化学式是HnXOm,这种元素的气态氢化物中X元素的化合价为( )
| A. | 8-2m+n | B. | 2m-n | C. | 2m-n-8 | D. | n-2m |
7.下列叙述中正确的是( )
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 由非金属组成的化合物不一定是共价化合物 | |
| C. | 只有非金属单质分子里存在非极性键 | |
| D. | 离子化合物只含有离子键 |
14.生物体中细胞内的葡萄糖,细胞膜外的富氧液体及细胞膜可构成微型生物原电池,下列有关判断正确的是( )
| A. | 负极发生的电极反应可能是:O2+4e-+2H2O═4OH - | |
| B. | 正极发生的电极反应可能是:O2+4e-═2O2- | |
| C. | 正极反应主要是:C6H12O6生成CO2或CO32- | |
| D. | 负极反应主要是:C6H12O6生成 CO2或 HCO3- |
12.下列所示的实验操作中,正确的是( )
| A. |  向试管内加锌粒 | B. |  向试管内倒液体 | ||
| C. |  给试管内的液体加热 | D. |  用橡胶塞塞住试管 |
 .
. )不能与强碱性物质混合使用,其原因是
)不能与强碱性物质混合使用,其原因是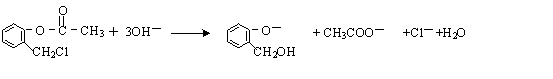 (写离子方程式).
(写离子方程式). )通过加成、取代等一系列转化合成某高分子化合物
)通过加成、取代等一系列转化合成某高分子化合物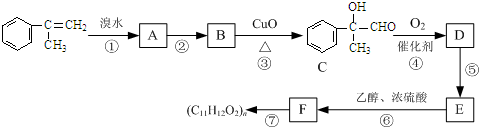
 、
、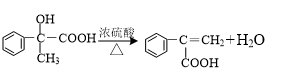 、
、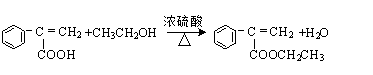 、
、 .
. ,Na在氧气中完全燃烧所得产物的电子式
,Na在氧气中完全燃烧所得产物的电子式