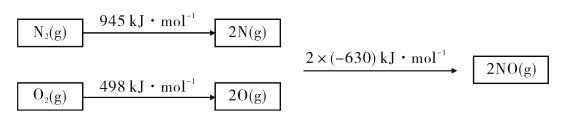
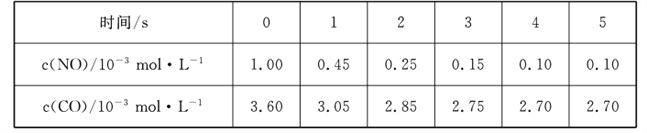
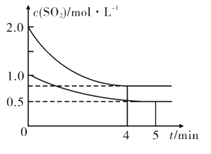
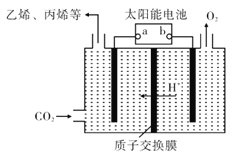
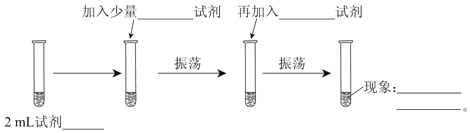
题目内容
【题目】(1)氨水中滴入酚酞显____________色,其原因是____________(用离子方程式表示)。
(2)0.1mol/L氨水与0.1mol/L盐酸等体积混合后,溶液中c(Cl-)________c(NH4+)(填“>”“<”或“=”)
(3)氨水与盐酸反应的产物常用于焊接金属前除去金属表面的氧化膜,其原因是____________。
【答案】红 NH·H2O![]() NH4++OH- > NH4++H2O
NH4++OH- > NH4++H2O![]() NH·H2O+H+,氯化铵溶液显酸性,能和金属的氧化膜发生反应
NH·H2O+H+,氯化铵溶液显酸性,能和金属的氧化膜发生反应
【解析】
(1)氨水中存在一水合氨的电离,NH·H2O![]() NH4++OH-,所以溶液显碱性,滴入酚酞会显红色;
NH4++OH-,所以溶液显碱性,滴入酚酞会显红色;
(2)0.1mol/L氨水与0.1mol/I盐酸等体积混合后溶液中的溶质为NH4Cl,由于铵根会发生水解,所以c(Cl-)> c(NH4+);
(3)氨水与盐酸反应的产物为氯化铵,由于铵根水解:NH4++H2O![]() NH·H2O+H+,溶液会显酸性,能和金属的氧化膜发生反应。
NH·H2O+H+,溶液会显酸性,能和金属的氧化膜发生反应。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
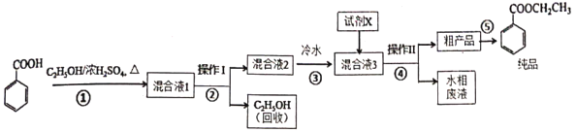
寒假天地重庆出版社系列答案【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温颜色状态 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
⑴为提高原料苯甲酸的纯度,可采用的纯化方法为________。
⑵步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5至2h。仪器A的作用是________________;仪器C中反应液应采用________方式加热。
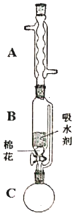
⑶随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为________。
⑷反应结束后,对C中混合液进行分离提纯,操作Ⅰ是____;操作Ⅱ所用的玻璃仪器除了烧杯外还有_____。
⑸向混合液3中加入的试剂X为________(填写化学式)。
⑹最终得到产物纯品12.0g,实验产率为________%(保留三位有效数字)。
【题目】某研究性学习小组设计实验探究元素周期律和化学反应速率。
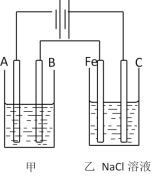
(1)甲组同学欲用下图装置探究同周期和同主族元素非金属性的强弱。
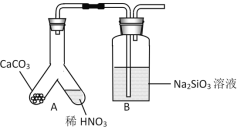
①A中反应现象为____,验证碳的非金属性比氮的___(填“强”或“弱”)。
②B中反应现象为____,验证碳的非金属性比硅的___(填“强”或“弱”)。
③结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”); 同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
④某同学考虑到稀硝酸的挥发,在装置A和B之间增加一个盛有_______试剂的洗气瓶。
(2)乙组同学在恒容容器中进行了三个实验,反应为:2HI(g)H2(g)+I2(g),H2和I2的起始浓度均为0,反应物HI的浓度随反应时间的变化情况如下表:
实验序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 400 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
2 | 400 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 450 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
①实验1中,在10~20 min内,v(HI)=__________molL-1min-l。
②0~20 min内,实验2比实验1的反应速率______(填“快”或“慢”),其原因可能是_______________。
③实验3比实验2的反应达到平衡时间_________(填“长”或“短”),其原因是_________________________________________。
【题目】已知常温下部分弱电解质的电离常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | Ka=6.8×10-4 | Ka=4.7×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Kb=1.7×10-5 |
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是____________(填字母)。
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为________。
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-) ______ c(![]() )(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
)(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为:__________________________。
(5)常温下,计算NH4Cl溶液中,![]() 的水解常数Kh=_________________。
的水解常数Kh=_________________。