题目内容
【题目】常温下,H2A和H2NCH2CH2NH2溶液中各组分的物质的量分数δ随pH的变化如图(I)、(II)所示。下列说法不正确的是已知:![]() 。
。
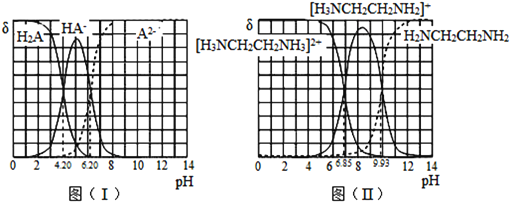
A.NaHA溶液中各离子浓度大小关系为:![]()
B.乙二胺(H2NCH2CH2NH2)的Kb2=10-7.15
C.[H3NCH2CH2NH3]A溶液显碱性
D.向[H3NCH2CH2NH2] HA溶液中通人HCl,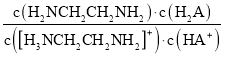 不变
不变
【答案】C
【解析】
A.由图1可知,当c(HA-)=c(A2-)时,溶液显酸性,所以NaHA溶液显酸性,电离程度大于水解程度,则各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故A正确;
B.由图2可知,当c([H3NCH2CH2NH2]+)=c[H3NCH2CH2NH3]2+)时,溶液的pH=6.85,c(OH-)=10-7.15mol·L-1,则
Kb2=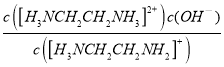 =c(OH-),Kb2=10-7.15,故B正确;
=c(OH-),Kb2=10-7.15,故B正确;
C.由图2可知,当c([H3NCH2CH2NH3]2+)=c([H3NCH2CH2NH]+)时,溶液的pH=6.85,c(OH-)=10-7.15mol·L-1,则Kb2=10-7.15,由图1可知,当c(HA-)=c(A2-)时,pH=6.2,则Ka2=10-6.2,[H3NCH2CH2NH3]2+的水解程度大于A2-的水解程度,溶液显酸性,故C错误;
D.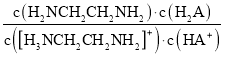 =
=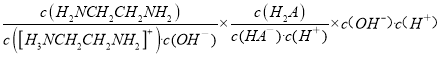
=![]() ,由于通入HCl,Kw、Kb1、Ka1都不变,所以
,由于通入HCl,Kw、Kb1、Ka1都不变,所以
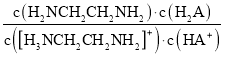 不变,故D正确。
不变,故D正确。
故选C。

【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列常见古诗文对应化学知识正确的是![]()
选项 | 古诗文 | 化学知识 |
A |
| 冰能量低于水,冰变为水属于吸热反应 |
B |
| “强水”是指氢氟酸 |
C |
| 剂钢为铁的合金,其硬度比纯铁的大,熔点比纯铁的高 |
D |
| 鉴别硝石和朴硝利用了焰色反应 |
A.AB.BC.CD.D
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
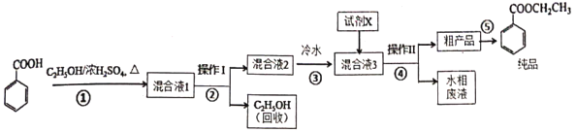
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温颜色状态 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
⑴为提高原料苯甲酸的纯度,可采用的纯化方法为________。
⑵步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5至2h。仪器A的作用是________________;仪器C中反应液应采用________方式加热。

⑶随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为________。
⑷反应结束后,对C中混合液进行分离提纯,操作Ⅰ是____;操作Ⅱ所用的玻璃仪器除了烧杯外还有_____。
⑸向混合液3中加入的试剂X为________(填写化学式)。
⑹最终得到产物纯品12.0g,实验产率为________%(保留三位有效数字)。
【题目】某研究性学习小组设计实验探究元素周期律和化学反应速率。
(1)甲组同学欲用下图装置探究同周期和同主族元素非金属性的强弱。
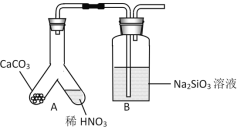
①A中反应现象为____,验证碳的非金属性比氮的___(填“强”或“弱”)。
②B中反应现象为____,验证碳的非金属性比硅的___(填“强”或“弱”)。
③结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”); 同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
④某同学考虑到稀硝酸的挥发,在装置A和B之间增加一个盛有_______试剂的洗气瓶。
(2)乙组同学在恒容容器中进行了三个实验,反应为:2HI(g)H2(g)+I2(g),H2和I2的起始浓度均为0,反应物HI的浓度随反应时间的变化情况如下表:
实验序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 400 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
2 | 400 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 450 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
①实验1中,在10~20 min内,v(HI)=__________molL-1min-l。
②0~20 min内,实验2比实验1的反应速率______(填“快”或“慢”),其原因可能是_______________。
③实验3比实验2的反应达到平衡时间_________(填“长”或“短”),其原因是_________________________________________。