题目内容
1.Ⅰ.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.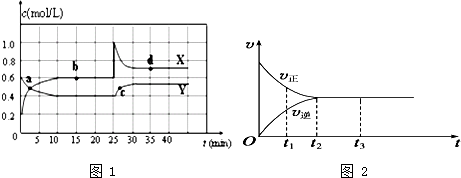
(1)该反应的化学方程式为 (反应物或生成物用符号X、Y表示):Y?2X.
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是b、d.
Ⅱ.(3)如图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是BD
A.t1时,只有正方向反应 B.t2时,反应达到限度
C.t2~t3,反应不再发生 D.t2~t3,各物质的浓度不再发生变化
Ⅲ.以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量
| 时间(s)物质的量(mol)物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(4)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1.
(5)根据素材2中分析得到,提高该化学反应限度的途径有增大压强或在一定范围内降低温度.
(6)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是温度为600℃,压强为1MPa.
分析 I.(1)由图可知,X的物质的量增加,Y的物质的量减少,则X为生成物,Y为反应物,浓度变化量之比等于化学计量数之比,进而书写化学方程式;
(2)处于平衡状态时,各组分的浓度不发生变化;
II.(3)A.t1时正、逆反应都发生,且正方向反应速率大于逆反应速率;
B.t2时正、逆反应速率相等;
C.t2-t3段正、逆反应速率相等,处于平衡状态,可逆反应为动态平衡;
D.t2-t3段处于化学平衡状态;
III.(4)由素材1可知,20-30s内二氧化硫的物质的量的变化量为0.5mol-0.35mol=0.15mol,根据v=$\frac{△c}{△t}$计算v(SO2);
(5)由素材2可知,压强越大、温度越低时,SO2的转化率越大,化学反应的限度越大;
(6)根据素材1计算二氧化硫的转化率,利用素材2来确定合适的温度、压强.
解答 解:I.(1)由图可知,X的物质的量增加,Y的物质的量减少,则X为生成物,Y为反应物,由10mim达到平衡可知,Y、X的浓度变化量之比为(0.6-0.4)mol/L:(0.6-0.2)mol/L=1:2,则反应方程式为:Y?2X,
故答案为:Y?2X;
(2)由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:b、d;
II.(3)A.t1时正逆反应都发生,且正方向反应速率大于逆反应速率,故A错误;
B.t2时正、逆反应速率相等,则反应到达限度,故B正确;
C.t2-t3段正、逆反应速率相等,化学反应达到动态平衡,故C错误;
D.t2-t3段处于化学平衡状态,各物质的浓度不再发生变化,故D正确;
故选:BD;
III.(4)由素材1可知,20-30s内二氧化硫的物质的量的变化量为0.5mol-0.35mol=0.15mol,
则二氧化硫表示的化学反应的平均速率为$\frac{\frac{0.15mol}{2L}}{10s}$=0.0075 mol•L-1•s-1,
故答案为:0.0075 mol•L-1•s-1;
(5)由素材2可知,压强越大、温度越低时有利于提高该化学反应限度,但温度太低时反应速率较慢,
故答案为:增大压强或在一定范围内降低温度;
(6)由素材1可知,50s时反应达到平衡,则二氧化硫的转化率为$\frac{1mol-0.1mol}{1mol}$=90%,结合素材2可知,转化率为90%时温度为600℃,压强为1MPa,
故答案为:温度为600℃,压强为1MPa.
点评 本题考查化学反应速率及化学平衡图象,注重对图象的分析,明确图象中纵横坐标及点、线、面的意义是解答本题的关键,难度不大.

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 道尔顿提出原子学说 | |
| B. | 门捷列夫提出了元素周期律 | |
| C. | 汤姆生发现电子,并提出原子结构轨道模型 | |
| D. | 舍勒发现了氯气 |
| A. | 有绿色气体产生 | B. | 没有沉淀生成 | ||
| C. | 有白色沉淀生成 | D. | 有红褐色沉淀生成 |
| 编号 | 碘酸钾浓度/mol/L | pH | 碘酸钾损失率/% | |||
| 30℃ | 50℃ | 80℃ | 100℃ | |||
| 1 | 0.003 | 0 | 21 | 70.3 | 71 | 77.3 |
| 2 | 0.003 | 7 | 0 | 0.3 | 0.67 | 1 |
| 3 | 0.003 | 14 | 1.3 | 2.7 | 1.3 | 1 |
(2)pH=7时,随着温度的升高碘酸钾的稳定性减弱.(填“增强”,“不变”或“减弱”);
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:取样,加淀粉溶液,如溶液变蓝说明有碘生成,反之,没碘生成.
| A. | Al(OH)3 沉淀 | B. | 只有AlO2-离子 | ||
| C. | Al(OH)3 沉淀和Al3+ | D. | Al(OH)3 沉淀 和AlO2-离子 |
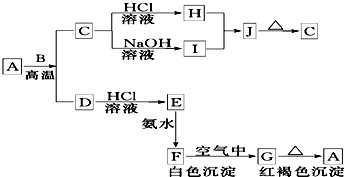 A是一种红棕色金属氧化物,B、D是金属单质,C也是一种金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,C也是一种金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体,受热后容易发生分解.