题目内容
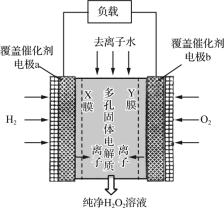
【题目】观察下列装置,回答下列问题。
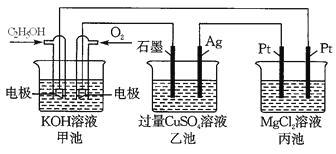
(1) 甲装置中通入乙醇的电极反应式为_______________________________________。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上的电极反应式是________,在Ag电极附近观察到的现象是_____________________________。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),此时乙装置中溶液的pH为_______(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是_____________,其物质的量为___________。
(4) 丙装置中总反应的离子方程式为____________________________________________。
【答案】C2H5OH-12e-+16OH-==2CO32-+11H2O 4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+ 有红色固体(Cu)析出 1 CuO或CuCO3 0.01mol Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑。
Mg(OH)2↓+H2↑+Cl2↑。
【解析】
甲池为燃料电池,乙池和丙池都为电解池。甲池中,加入乙醇的电极为负极,通氧气的电极为正极;则乙池中石墨电极为阳极,Ag电极为阴极;丙池中,左边Pt电极为阳极,右边Pt电极为阴极。
(1) 甲装置中加入乙醇的电极为负极,乙醇失电子,生成的产物再与KOH溶液反应,最后生成碳酸盐和水。
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上发生H2O失电子生成O2和H+的反应,在Ag电极上发生Cu2+得电子生成Cu的反应,由此可确定此电极附近观察到的现象。
(3) 电解一段时间,当甲池消耗了112 mLO2(标况下),利用电荷守恒,可求出乙装置中生成n(H+),从而求出溶液的pH。若要将该溶液完全恢复到电解前的浓度和pH,则需往溶液中加入阴、阳极生成物发生化合反应的产物。
(4) 丙装置中电解MgCl2溶液,可利用电解饱和食盐水的反应进行类推,同时要注意差异性,即生成Mg(OH)2沉淀。
(1)甲装置中加入乙醇的电极为负极,乙醇失电子,生成的产物再与KOH溶液反应,最后生成碳酸盐和水,电极反应式为C2H5OH-12e-+16OH-==2CO32-+11H2O。答案为:C2H5OH-12e-+16OH-==2CO32-+11H2O;
(2) 用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极(阳极)上发生H2O失电子生成O2和H+的反应,电极反应式为4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;在Ag电极(阴极)上发生反应Cu2++2e-=Cu,此电极附近观察到的现象为有红色固体(Cu)析出。答案为:4OH--4e-==H2O+O2↑或 2H2O-4e-==O2↑+4H+;有红色固体(Cu)析出;
(3)n(O2)=![]() =0.005mol,由O2——4H+,可求出n(H+)=0.005mol×4=0.02mol,c(H+)=
=0.005mol,由O2——4H+,可求出n(H+)=0.005mol×4=0.02mol,c(H+)=![]() =0.1mol/L,pH=1。阳极生成O2(0.005mol),阴极生成Cu(0.01mol),2Cu+O2=2CuO(0.01mol),所以需往电解后的溶液中加入0.01mol CuO或CuCO3,可将该溶液完全恢复到电解前的浓度和pH。答案为:有红色固体(Cu)析出;1;CuO或CuCO3;0.01mol;
=0.1mol/L,pH=1。阳极生成O2(0.005mol),阴极生成Cu(0.01mol),2Cu+O2=2CuO(0.01mol),所以需往电解后的溶液中加入0.01mol CuO或CuCO3,可将该溶液完全恢复到电解前的浓度和pH。答案为:有红色固体(Cu)析出;1;CuO或CuCO3;0.01mol;
(4) 丙装置中电解MgCl2溶液,可利用电解饱和食盐水的反应进行类推,从而得出总反应的离子方程式为Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑。答案为:Mg2++2Cl-+2H2O
Mg(OH)2↓+H2↑+Cl2↑。答案为:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑。
Mg(OH)2↓+H2↑+Cl2↑。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案