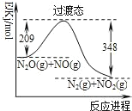
ЬтФПФкШн
ЁОЬтФПЁПЯѕЫсЪЧживЊЕФбѕЛЏМСЃЌЬњЁЂЭЪЧЩњЛюжаГЃМћЕФН№ЪєЃЎ
ЃЈ1ЃЉFeгыCuЛьКЯЮягы65%ЕФЯѕЫсЗДгІЛсВњЩњДѓСПNO2ЃЌИУЗДгІЪЙгУЕФЯѕЫсЕФЮяжЪЕФСПХЈЖШЮЊ______mol/LЃЈвбжЊІб=1.4g/cm3ЃЉЃЎ
ЃЈ2ЃЉИїЮЊ0.1molЕФCuгыFeЛьКЯЮягызуСПЕФФГХЈЖШЕФЯѕЫсЗДгІВњЩњ4.48LЦјЬхЃЈБъзМзДПіЯТЃЉЃЌдђИУЗДгІЯћКФЕФЯѕЫсЮЊ______molЃЎ
ЃЈ3ЃЉ4.4gFeгыCuЛьКЯЮягыЙ§СПЕФЯѕЫсЗДгІЃЌЗХГіЕФЦјЬхгыБъзМзДПіЯТЕФ1.12LЕФбѕЦјЛьКЯКѓЭЈШыЫЎжаЧЁКУБЛЭъШЋЮќЪеЃЌдђЦфжаЭЕФжЪСПЮЊ______gЃЎ
ЃЈ4ЃЉFeгыCuЛьКЯЮяЙВгаa molЃЌЦфжаЭЕФЮяжЪЕФСПЗжЪ§ЮЊXЃЌНЋИУЛьКЯЮяШЋВПЭЖШыb molЕФЯѕЫсжаЪЙЦфГфЗжЗДгІЃЌМйЖЈЯѕЫсЕФЛЙдВњЮяНігаNOЃЌ
ЂйШєШмвКжаН№ЪєРызгжЛгаFe2+ЁЂCu2+ЪБЃЌдђbЕФШЁжЕЗЖЮЇЪЧ______ЃЈгУaЁЂxБэЪОЃЉЃЎ
ЂкШєx=0.2ЪБЃЌШмвКFe2+гыFe3+ЕФЮяжЪЕФСПЯрЕШЪБЃЌдкБъзМзДПіЯТВњЩњNO 6.72LЃЌЧѓaЁЂbЕФжЕЃЎЃЈаДГіМђвЊЕФМЦЫуЙ§ГЬЃЉ___________
ЁОД№АИЁП14.44 0.7 1.6 ![]() ЃМbЁм
ЃМbЁм![]() aЕФжЕЮЊ0.375ЃЌbЕФжЕЮЊ1.2
aЕФжЕЮЊ0.375ЃЌbЕФжЕЮЊ1.2
ЁОНтЮіЁП
(1)вРОнШмвКжаШмжЪЮяжЪЕФСПХЈЖШКЭШмжЪжЪСПЗжЪ§ЕФЛЛЫуЙиЯЕМЦЫуЕУЕНЃЌc=![]() ЃЛ
ЃЛ
(2)ЭКЭЬњгызуСПЯѕЫсЗДгІЗЂЩњбѕЛЏЛЙдЗДгІЃЌЯѕЫсБЛЛЙдЮЊЕЊбѕЛЏЮяЃЌН№ЪєБЛбѕЛЏЮЊЯѕЫсбЮЃЌвРОнЕЊдЊЫиЪиКуМЦЫудЊЯѕЫсШмвКЕФХЈЖШЃЛ
(3)ЭЁЂЬњгыЙ§СПЕФЯѕЫсЗДгІЩњГЩЯѕЫсЭЁЂЯѕЫсЬњгыЕЊЕФбѕЛЏЮяЃЌЕЊЕФбѕЛЏЮягыбѕЦјЁЂЫЎЗДгІЩњГЩЯѕЫсЃЌзнЙлећИіЙ§ГЬЃЌН№ЪєЬсЙЉЕФЕчзгЕШгкбѕЦјЛёЕУЕФЕчзгЃЌИљОнЖўепжЪСПгыЕчзгзЊвЦСаЗНГЬМЦЫуЃЎИљОнm=nMМЦЫуЭЕФжЪСПЃЛ
(4)ЂйЕБШмвКжаЕФН№ЪєРызгжЛгаFe2+ЁЂCu2+ЪБЃЌЫЕУїCuЧЁКУЭъШЋЗДгІЛђепгаЪЃгрЃЌЖјHNO3КЭFeдђЭъШЋЗДгІЃЈШчЙћгаЯѕЫсЪЃгрЃЌдђFe2+дђЛсБЛНјвЛВНбѕЛЏЮЊFe3+ЃЛШчЙћгаFeЪЃгрЃЌдђЛсКЭCu2+МЬајЗДгІЃЉЃЌHNO3ЁњNOЃЌNЕУ3ЕчзгЃЌЩшБЛЛЙдЕФHNO3ЮЊy molЃЌзмМЦЕУ3y molЕчзгЃЌCuЁњCu2+ЃЌCuЪЇ2ЕчзгЃЌЩшВЮМгЗДгІЕФCuЮЊz molЃЌзмМЦЪЇ2z molЕчзгЃЌ
FeЁњFe2+ЃЌFeЪЇ2ЕчзгЃЌВЮМгЗДгІЕФFeЮЊa(1Љx)molЃЌзмМЦЪЇ2a(1Љx)molЕчзгЃЌИљОнЕУЪЇЕчзгзмЪ§ЯрЕШЃЌЫљвдЃК3y=2z+2a(1Љx) ЂйЃЌЗДгІжаЦ№ЫсзїгУЕФЯѕЫсЩњГЩFe(NO3ЃЉ2КЭCu(NO3)2ЃЌЦ№бѕЛЏМСзїгУЕФЯѕЫсЩњГЩNOЃЌгЩNдЊЫиЪиКуЃЌЫљвдгаЃКy+2a(1Љx)+2z=b ЂкЃЌСЊСЂЗНГЬЃЌЯћШЅyЃЌПЩЕУbЕФБэДяЪНЃЈгУaЁЂxЁЂzБэЪОЃЉЃЌВЮМгЗДгІЕФCuЕФЮяжЪЕФСПzЕФШЁжЕДѓгк0ЃЌзюДѓЮЊaxЃЌДјШыbЕФБэДяЪНМЦЫуЃЛ
ЂкЕБx=0.2ЃЌШмвКжаFe3+КЭFe2+ЕФЮяжЪЕФСПЯрЕШЪБЃЌCuШЋВПЮЊЭРызгЃЌИљОнЕУЪЇЕчзгЪиКуКЭЕЊдзгЪиКуМЦЫуЁЃ
(1)FeгыCuЛьКЯЮягы65%ЕФЯѕЫсЗДгІЛсВњЩњДѓСПNO2ЃЌИУЗДгІЪЙгУЕФЯѕЫсЕФЮяжЪЕФСПХЈЖШ=![]() =14.44mol/LЃЛ
=14.44mol/LЃЛ
(2)ИїЮЊ0.1molЕФCuгыFeЛьКЯЮягызуСПЕФФГХЈЖШЕФЯѕЫсЗДгІВњЩњ4.48LЦјЬхЃЈБъзМзДПіЯТЃЉЃЌЮяжЪЕФСПn=![]() =0.2molЃЌЭКЭЬњгызуСПЯѕЫсЗДгІЗЂЩњбѕЛЏЛЙдЗДгІЃЌЯѕЫсБЛЛЙдЮЊЕЊбѕЛЏЮяЃЌН№ЪєБЛбѕЛЏЮЊЯѕЫсбЮЃЌCu(NO3)2ЃЌFe(NO3)3ЃЌЕЊдЊЫиЪиКуМЦЫуЃЌдђИУЗДгІЯћКФЕФЯѕЫсЮяжЪЕФСП=0.1molЁС2+0.1molЁС3+0.2mol=0.7molЃЛ
=0.2molЃЌЭКЭЬњгызуСПЯѕЫсЗДгІЗЂЩњбѕЛЏЛЙдЗДгІЃЌЯѕЫсБЛЛЙдЮЊЕЊбѕЛЏЮяЃЌН№ЪєБЛбѕЛЏЮЊЯѕЫсбЮЃЌCu(NO3)2ЃЌFe(NO3)3ЃЌЕЊдЊЫиЪиКуМЦЫуЃЌдђИУЗДгІЯћКФЕФЯѕЫсЮяжЪЕФСП=0.1molЁС2+0.1molЁС3+0.2mol=0.7molЃЛ
(3)ЭЁЂЬњгыЙ§СПЯѕЫсЗДгІЩњГЩЯѕЫсЭЁЂЯѕЫсвјЬњгыЕЊЕФбѕЛЏЮяЃЌЕЊЕФбѕЛЏЮягыбѕЦјЁЂЫЎЗДгІЩњГЩЯѕЫсЃЌзнЙлећИіЙ§ГЬЃЌН№ЪєЬсЙЉЕФЕчзгЕШгкбѕЦјЛёЕУЕФЕчзгЃЌn(O2)=![]() =0.05molЃЌЩшCuЁЂFeЕФЮяжЪЕФСПЗжБ№ЮЊxЁЂyЃЌдђЃКИљОнжЪСПСаЗНГЬЃКxЁС64g/mol+yЁС56g/mol=4.4gИљОнЕчзгЪиКуСаЗНГЬЃК2x+3ЁСy=0.05molЁС4ЃЌНтЕУЃКx=0.025molЃЛy=0.05mol ЃЌm(Cu)=0.025molЁС64g/mol=1.6gЃЛ
=0.05molЃЌЩшCuЁЂFeЕФЮяжЪЕФСПЗжБ№ЮЊxЁЂyЃЌдђЃКИљОнжЪСПСаЗНГЬЃКxЁС64g/mol+yЁС56g/mol=4.4gИљОнЕчзгЪиКуСаЗНГЬЃК2x+3ЁСy=0.05molЁС4ЃЌНтЕУЃКx=0.025molЃЛy=0.05mol ЃЌm(Cu)=0.025molЁС64g/mol=1.6gЃЛ
(4)ЂйЕБШмвКжаЕФН№ЪєРызгжЛгаFe2+ЁЂCu2+ЪБЃЌЫЕУїCuЧЁКУЭъШЋЗДгІЛђепгаЪЃгрЃЌЖјHNO3КЭFeдђЭъШЋЗДгІЃЈШчЙћгаЯѕЫсЪЃгрЃЌдђFe2+дђЛсБЛНјвЛВНбѕЛЏЮЊFe3+ЃЛШчЙћгаFeЪЃгрЃЌдђЛсКЭCu2+МЬајЗДгІЃЉЃЌHNO3ЁњNOЃЌNЕУ3ЕчзгЃЌЩшБЛЛЙдЕФHNO3ЮЊy molЃЌзмМЦЕУ3y molЕчзгЃЌCuЁњCu2+ЃЌCuЪЇ2ЕчзгЃЌЩшВЮМгЗДгІЕФCuЮЊz molЃЌзмМЦЪЇ2z molЕчзгЃЌFeЁњFe2+ЃЌFeЪЇ2ЕчзгЃЌВЮМгЗДгІЕФFeЮЊa(1Љx)molЃЌзмМЦЪЇ2a(1Љx)molЕчзгЃЌИљОнЕУЪЇЕчзгзмЪ§ЯрЕШЃЌЫљвдЃК3y=2z+2a(1Љx) ЂйЃЌЗДгІжаЦ№ЫсзїгУЕФЯѕЫсЩњГЩFe(NO3)2КЭCu(NO3)2ЃЌЦ№бѕЛЏМСзїгУЕФЯѕЫсЩњГЩNOЃЌгЩNдЊЫиЪиКуЃЌЫљвдгаЃКy+2a(1Љx)+2z=b ЂкЃЌСЊСЂЗНГЬЃЌЯћШЅyЃЌећРэЕУb=8z+![]() ЂлЃЌВЮМгЗДгІЕФCuЕФЮяжЪЕФСПzЕФШЁжЕДѓгк0ЃЌзюДѓЮЊaxЃЌДјШыЂлжаЃЌПЩЕУ
ЂлЃЌВЮМгЗДгІЕФCuЕФЮяжЪЕФСПzЕФШЁжЕДѓгк0ЃЌзюДѓЮЊaxЃЌДјШыЂлжаЃЌПЩЕУ![]() ЃМbЁм
ЃМbЁм![]() ЃЛ
ЃЛ
ЂкЕБx=0.2ЃЌШмвКжаFe3+КЭFe2+ЕФЮяжЪЕФСПЯрЕШЪБЃЌCuШЋВПЮЊЭРызгЃЌЫљвдВЮМгЗДгІЕФCuЮЊ0.2amolЃЌFe3+КЭFe2+ЕФЮяжЪЕФСПИїЮЊ0.4amolЃЌHNO3ЁњNOЃЌNЕУ3ЕчзгЃЌВњЩњ6.72LNOЦјЬхМД0.3molЃЌзмМЦЕУ0.9 molЕчзгЃЌCuЁњCu2+ЃЌCuЪЇ2ЕчзгЃЌдђЪЇ0.4a molЕчзгЃЌFeЁњFe2+ЃЌFeЪЇ2ЕчзгЃЌдђЪЇ0.8amolЕчзгЃЌFeЁњFe3+ЃЌFeЪЇ3ЕчзгЃЌдђЪЇ1.2amolЕчзгЃЌИљОнЕУЪЇЕчзгзмЪ§ЯрЕШЃЌЫљвдЃК0.9=0.4a+0.8a+1.2aЃЌНтЕУa=0.375molЃЌИљОнЕЊдзгЪиКуПЩжЊЃКb=2n(Cu2+)+2n(Fe2+)+3n(Fe3+)+2n(NO)=2ЁС0.2ЁС0.375+2ЁС0.4ЁС0.375+3ЁС0.4ЁС0.375+0.3=1.2molЃЛ

ЁОЬтФПЁПЧыЛиД№вдЯТЮЪЬт
ЃЈ1ЃЉФГЮТЖШЪБЃЌВтЕУpHЃН11ЕФBa(OH)2ШмвКХЈЖШЪЧ0.005molЁЄLЃ1ЁЃ
ЂйИУЮТЖШЯТЫЎЕФРызгЛ§ГЃЪ§KwЃН________ЁЃ
ЂкдкДЫЮТЖШЯТЃЌНЋpHЃН12ЕФBa(OH)2ШмвКVa LгыpHЃН2ЕФСђЫсVb LЛьКЯЁЃШєЫљЕУЛьКЯвКЮЊжаадЃЌдђVaЁУVbЃН________ЁЃ
ЃЈ2ЃЉ25 ЁцЪБЃЌВПЗжЮяжЪЕФЕчРыЦНКтГЃЪ§ШчЯТБэЫљЪОЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЛЏбЇЪН | CH3COOH | H2CO3 | HClO |
ЕчРыЦНКтГЃЪ§ | 1.8ЁС10ЁЊ5 | K1ЃН4.3ЁС10Ѓ7 K2ЃН5.6ЁС10Ѓ11 | 3.0ЁС10Ѓ8 |
ЂйЯТСаЫЕЗЈе§ШЗЕФЪЧ__________
AЃЎ25 ЁцЪБЃЌЯђCH3COOHШмвКжаМгШыЪЪСПЕФNaOHШмвКЃЌCH3COOHЕФЕчРыГЬЖШдіДѓЃЌЕчРыЦНКтГЃЪ§ВЛБф
BЃЎ0.1molL-1 CH3COOHШмвКМгЫЎЯЁЪЭЃЌЯЁЪЭКѓЕФШмвКжаЫЎЕФЕчРыГЬЖШМѕаЁ
CЃЎ0.1molL-1 HClOШмвККЭ0.1molL-1 NaClOШмвКЕШЬхЛ§ЛьКЯГЪШмвКМюад
DЃЎЬМЫсЧтФЦШмвКжавѕбєРызгЪ§ФПЯрЕШ
Ђк ЭЌХЈЖШЕФCH3COOЃЁЂHCOЁЂCO32-ЁЂClOЃНсКЯHЃЋЕФФмСІгЩЧПЕНШѕЕФЫГађЮЊ___
Ђл 25 ЁцЪБЃЌФГCH3COOHКЭCH3COOKЛьКЯШмвКГЪжаадЃЌдђИУЛьКЯШмвКжаЃК![]() =________
=________
ЃЈ3ЃЉУКШМЩеХХЗХЕФбЬЦјКЌгаSO2КЭNOЃЌВЩгУМюадЕФNaClO2ШмвКзїЮЊЮќЪеМСПЩЭЌЪБЖдбЬЦјНјааЭбСђЁЂЭбЯѕЁЃдкЙФХнЗДгІЦїжаЭЈШыКЌгаSO2КЭNOЕФбЬЦјЃЌЗДгІЮТЖШЮЊ323 KЃЌNaClO2ШмвКХЈЖШЮЊ5ЁС103molЁЄL1ЁЃЗДгІ10minКѓШмвКжаРызгХЈЖШЕФЗжЮіНсЙћШчЯТБэЁЃ
Рызг | SO42 | SO32 | NO3 | NO2 | Cl |
c/ЃЈmolЁЄL1ЃЉ | 8.35ЁС104 | 6.87ЁС106 | 1.5ЁС104 | 1.2ЁС105 | 3.4ЁС103 |
ЂйаДГіNaClO2ШмвКЭбЯѕЙ§ГЬжажївЊЗДгІЕФРызгЗНГЬЪН______ЁЃ
ЂкШчЙћВЩгУCa(ClO)2ЬцДњNaClO2ЃЌЦфЭбСђаЇЙћЛсИќКУЁЃЪдДгЛЏбЇЦНКтдРэЗжЮіЃЌCa(ClO)2ЯрБШNaClO2ОпгаЕФгХЕуЪЧ________ЁЃ