题目内容
燃料电池的突出优点是把化学能直接转变为电能,而不经过热能中间形式,现已广泛使用。如甲烷燃料电池,其电极反应为:负极:CH4+10OH- -8e- = CO32-+7H2O
正极:2O2+8e-+4H2O = 8OH-。今欲得27g水,则电池中电子转移的物质的量为
正极:2O2+8e-+4H2O = 8OH-。今欲得27g水,则电池中电子转移的物质的量为
| A.1mol | B.2mol | C.4mol | D.6mol |
C
考点:原电池和电解池的工作原理.
专题:计算题;电化学专题.
分析:先根据电极反应式写出电池反应式,再根据水和转移电子的关系式计算.
解答:解:CH4+10 OH--8e-=CO32-+7H2O ①
2O2+8e-+4H2O=8OH-. ②
将方程式①+②得 CH4 +2OH-+2O2=3H2O+CO32-转移电子
(3×18)g 8mol
27g 4mol
故选C
点评:本题以原电池为载体考查了方程式的有关计算,两电极上电极反应式相加即得电池反应方程式,要注意得失电子数相等时才能相加,得出电池反应方程式是解本题的关键.

练习册系列答案
相关题目
 Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
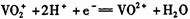
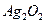 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在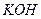 加入适量
加入适量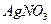 溶液,生成
溶液,生成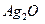 沉淀,保持反应温度为80,边搅拌边将一定量
沉淀,保持反应温度为80,边搅拌边将一定量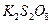 溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为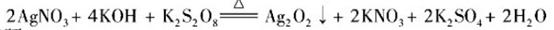
 ,负极的
,负极的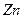 转化为
转化为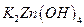 ,写出该电池反应方程式: .
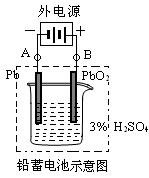
,写出该电池反应方程式: . 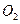 ,得到224.0mL
,得到224.0mL 2PbSO4+2H2O
2PbSO4+2H2O