题目内容
4.海水开发利用的部分过程如图所示.下列说法错误的是( )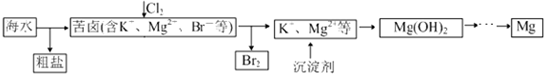
| A. | 粗盐可采用除杂和重结晶等过程提纯 | |
| B. | 向苦卤中通入Cl2 是为了提取溴 | |
| C. | 实际生产中常选用Ca(OH)2作为沉淀剂 | |
| D. | 工业生产中电解熔融氧化镁的方法制取镁 |
分析 A.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时应加入试剂进行除杂,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯;
B.向苦卤中通入Cl2置换出溴单质,分离得到溴;
C.工业生产中用生石灰或石灰水转化成的氢氧化钙作镁离子的沉淀剂;
D.获取金属Mg是电解熔融氯化镁得到金属镁,依据电解原理分析产物判断.
解答 解:A.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯,故A正确;
B.向苦卤中通入Cl2置换出溴单质,分离得到溴,通入Cl2是为了提取溴,故B正确;
C、实际生产中常选用碳酸钙、氧化钙制取得到的Ca(OH)2作镁离子的沉淀剂,故C正确;
D.获取金属Mg是电解熔融氯化镁得到金属镁,氧化酶的熔点太高,不宜采用电解熔融物的方法,故D错误;
故选:D.
点评 本题考查海水资源的综合利用,注意掌握中学常见的化学工业,侧重对化学与技术的考查,难度不大.

练习册系列答案
相关题目
15.有关如图所示有机化合物的性质说法不正确的是( )
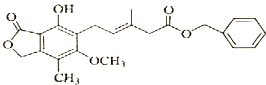

| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1 mol 该化合物最多可以与3 mol NaOH反应 | |
| C. | 既能催化加氢,又能使酸性KMnO4溶液褪色 | |
| D. | 既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应放出CO2气体 |
12.下列物质、类别、用途或储存方法对应关系都正确的是( )
| 选项 | A | B | C | D |
| 物质 | Na2CO3 | CH3COOH | NH3•HO2 | Na2SiO3 |
| 类别 | 碱 | 弱电解质 | 非电解质 | 强碱弱酸盐 |
| 用途或储存方法 | 氯碱工业产品之一 | 制食醋 | 棕色瓶密封保存 | 带玻璃塞的试剂瓶保存 |
| A. | A | B. | B | C. | C | D. | D |
9.等质量的烃完全燃烧,消耗氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C2H2 | D. | C6H6 |
16.已知某溶液中存在较多的H+和SO42-,则该溶液中还可以大量共存的离子组是( )
| A. | Na+、NH4+、Cl- | B. | Mg2+、Ba2+、Cl- | C. | Mg2+、Fe2+、NO3- | D. | Al3+、CO32-、Cl- |
13.实验室用碳酸钠晶体配制1.00mol•L-1的Na2CO3溶液100mL,造成所配溶液浓度偏低的原因是( )
| A. | 暴露在空气中称量碳酸钠晶体(Na2CO3•10H2O)的时间太长 | |
| B. | 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 | |
| C. | 定容时俯视刻度线 | |
| D. | 洗涤液移入容量瓶中时,洒出一部分 |
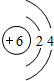 ,D元素在元素周期表中的位置为第四周期第ⅦA族.
,D元素在元素周期表中的位置为第四周期第ⅦA族. ,C、D两元素形成的化合物化学键类型为离子键.
,C、D两元素形成的化合物化学键类型为离子键.