题目内容
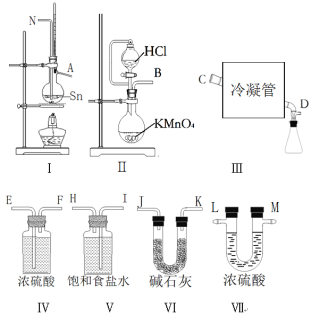
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡与Cl2反应制备SnCl4。拟利用图中的仪器,设计组装一套实验装置制备SnCl4(每个装置最多使用一次)。
已知:①有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ | |
Sn | 银白色固体 | 231.9 | 2260 | SnCl2易水解,SnCl4易水解生成固态二氧化锡, 锡与Cl2反应过程放出大量的热 |
SnCl4 | 无色液体 | -33 | 114 | |
SnCl2 | 无色晶体 | 246 | 652 |
②Fe3++Sn2+—Fe2++Sn4+ Fe2+ + Cr2O72- +H+—Fe3++Cr3++H2O(未配平)
回答下列问题:
(1)“冷凝管”的名称是________,装置Ⅱ中发生反应的离子方程式为________。
(2)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)_____。
(3)如何检验装置的气密性______,实验开始时的操作为_______。
(4)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是出现白色烟雾,化学方程式为_______。
(5)可用重铬酸钾滴定法测定产品中的SnCl2的含量,准确称取该样品m g放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成250mL溶液,取25.00mL于锥形瓶中,用0.1000mol·L-1重铬酸钾标准溶液滴定至终点,消耗标准液15.00mL,则产品中SnCl2的含量为____%(用含m的代数式表示),在测定过程中,测定结果随时间延长逐渐变小的原因是____(用离子方程式表示)。
【答案】直形冷凝管 2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O BIHEFNACDJK或BIHEFNACDKJ 关闭滴液漏斗活塞,将装置最后端的导气管插入水中,微热烧瓶,在导管末端有气泡产生,冷却烧瓶,在导管内形成一段高于液面的水柱,一段时间不发生变化,说明气密性良好 先打开Ⅱ中的活塞,待Ⅰ中烧瓶充满黄绿色气体后,点燃Ⅰ中的酒精灯 SnCl4+2H2O = SnO2+4HCl 855/m 2Sn2++O2+4H+=2Sn4++2H2O
【解析】
装置Ⅱ为制备氯气的装置,产生的氯气中会混有HCl和水蒸气等杂质气体,将气体通过V装置,V装置中的饱和食盐水可除去HCl,再将气体通过Ⅳ装置,Ⅳ装置中的浓硫酸可除去水蒸气,可得到干燥、纯净的氯气。将氯气通入Ⅰ装置,氯气与Sn反应可制得SnCl4蒸气,将SnCl4蒸气经装置Ⅲ冷却,可得到SnCl4液体。由于SnCl4易水解,为防止空气中的水蒸气进入装置Ⅲ以及吸收多余的Cl2,可在装置Ⅲ后连接Ⅵ装置。
(1)根据仪器特点解答仪器名称,装置II中KMnO4与HCl反应制Cl2;
(2)依据上述分析进行仪器连接;需注意制备的氯气应先除杂后干燥,干燥、纯净的氯气再和Sn反应,因为SnCl4易水解,应在收集SnCl4的装置后边连接干燥装置,防止空气中的水蒸气进入,同时要吸收尾气Cl2;
(3)气密性的检验可采用加热法,升高发生装置体系内气体的温度,可以增大压强,使体系内空气外逸,当温度恢复初始温度时,体系内压强减小,导致浸没在水中的导气管内倒吸一段水柱;防止Sn与O2反应以及防止生成的SnCl4水解,实验开始应先通Cl2排尽装置中空气;
(4)根据信息书写方程式;
(5)用重铬酸钾滴定法测定SnCl2时,发生的反应为2Fe3++Sn2+=2Fe2++Sn4+ 、6Fe2+ + Cr2O72- +14H+=6Fe3++2Cr3++7H2O,可得关系式3Sn2+~Cr2O72-,由消耗的K2Cr2O7计算SnCl2,进一步计算SnCl2的含量;Sn2+具有强还原性,易被O2氧化。
(1)“冷凝管”的名称是直形冷凝管;装置Ⅱ中是KMnO4和HC1制备氯气的反应,高锰酸钾中的锰元素由+7价降低到+2价生成Mn2+,HCl中的氯元素由-1价升高到0价生成氯气,离子反应方程式为2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O。本小题答案为:直形冷凝管;2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O。
(2)装置Ⅱ为制备氯气的装置,产生的氯气中会混有HCl和水蒸气等杂质气体,将气体通过V装置,V装置中的饱和食盐水可除去HCl,再将气体通过Ⅳ装置,Ⅳ装置中的浓硫酸可除去水蒸气,可得到干燥、纯净的氯气。将氯气通入Ⅰ装置,氯气与Sn反应可制得SnCl4蒸气,将SnCl4蒸气经装置Ⅲ冷却,可得到SnCl4液体。由于SnCl4易水解,为防止外界空气中的水蒸气进入装置Ⅲ以及吸收多余Cl2防污染大气,可在装置Ⅲ后连接Ⅵ装置。根据上述分析该装置的连接顺序是BIHEFNACDJK或BIHEFNACDKJ 。本小题答案为:BIHEFNACDJK或BIHEFNACDKJ 。
(3)检查装置的气密性用加热法,操作为:关闭滴液漏斗活塞,将装置最后端的导气管插入水中,微热烧瓶,在导管末端有气泡产生,冷却烧瓶,在导管内形成一段高于液面的水柱,一段时间不发生变化,说明气密性良好;防止Sn与O2反应以及防止生成的SnCl4水解,实验开始应先通Cl2排尽装置中空气,故实验开始时的操作为:先打开Ⅱ中的活塞,待Ⅰ中烧瓶充满黄绿色气体后,点燃Ⅰ中的酒精灯。本小题答案为:关闭滴液漏斗活塞,将装置最后端的导气管插入水中,微热烧瓶,在导管末端有气泡产生,冷却烧瓶,在导管内形成一段高于液面的水柱,一段时间不发生变化,说明气密性良好;先打开Ⅱ中的活塞,待Ⅰ中烧瓶充满黄绿色气体后,点燃Ⅰ中的酒精灯。
(4)根据表格所给信息,SnCl4易水解生成固态二氧化锡,将四氯化锡少许暴露于空气中,还可看到白色烟雾,说明水解产物中还有HCl,HCl与空气中的水蒸气形成盐酸小液滴,现象为白雾,化学方程式为SnCl4+2H2O = SnO2+4HCl。本小题答案为:SnCl4+2H2O = SnO2+4HCl。
(5)用重铬酸钾滴定法测定SnCl2时,发生的反应为2Fe3++Sn2+=2Fe2++Sn4+ 、6Fe2+ + Cr2O72- +14H+=6Fe3++2Cr3++7H2O,可得关系式3Sn2+~Cr2O72-(或根据得失电子守恒判断),实验中消耗的n(K2Cr2O7)= 0.1000mol·L-1×0.015L=0.0015mol,则25.00mLSnCl2溶液中n(SnCl2)=0.0015mol×3=0.0045mol,则250.00mLSnCl2溶液中n(SnCl2)=0.045mol,m(SnCl2)=0.045mol×190g/mol=8.55g,则mg产品中SnCl2的含量为8.55g/mg×100%=![]() %;根据反应“2Fe3++Sn2+=2Fe2++Sn4+”得出Sn2+的还原性强于Fe2+,Sn2+在空气中易被氧化,测定结果随时间延长逐渐变小是因为SnCl2被氧气氧化,发生2Sn2++O2+4H+=2Sn4++2H2O反应,滴定时消耗的重铬酸钾的量减少,由此计算出的SnClspan>2量减小,测量结果变小。本小题答案为:855/m ;2Sn2++O2+4H+=2Sn4++2H2O。
%;根据反应“2Fe3++Sn2+=2Fe2++Sn4+”得出Sn2+的还原性强于Fe2+,Sn2+在空气中易被氧化,测定结果随时间延长逐渐变小是因为SnCl2被氧气氧化,发生2Sn2++O2+4H+=2Sn4++2H2O反应,滴定时消耗的重铬酸钾的量减少,由此计算出的SnClspan>2量减小,测量结果变小。本小题答案为:855/m ;2Sn2++O2+4H+=2Sn4++2H2O。

【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为__________(填字母序号)。


![]()



(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B中发生反应的离子方程式____________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快” __________(选填“能”或“不能”);简述你的理由:_______________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有(___________)(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
①所用指示剂为__________;滴定终点时的现象为____________________________________;
②H2C2O4溶液物质的量浓度为__________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数