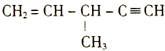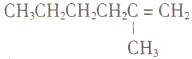题目内容
【题目】浓硫酸与金属的反应是我们一直探讨和研究的重要课题之一。
Ⅰ.铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O。则a:b=______.
cCu2S+dCuSO4+eH2O。则a:b=______.
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
(探究一)(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是________;
(2)铁与浓硫酸在加热时的化学方程式为:______________;
(3)称取碳素钢6.0g放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用____________;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为_______;
(探究二)根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体在标准状况下密度为0.0893g/L。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
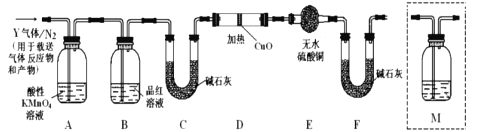
(4)装置B中试剂的作用是__________;
(5)分析Y气体中的![]() 气体是如何生成的___________(用化学方程式表示):
气体是如何生成的___________(用化学方程式表示):
(6)为确认![]() 的存在,需在装置中添加洗气瓶M于___________;
的存在,需在装置中添加洗气瓶M于___________;
a.A之前 b.A-B间 c.B-C间 d.C-D间
(7)如果气体Y中含有![]() ,预计实验现象应是_________________。
,预计实验现象应是_________________。
Ⅲ.将一定质量的Zn与100mL一定浓度的H2SO4充分反应:
(1)若反应前c(H2SO4)=12.0mol/L,反应后称量剩余锌发现质量减少了65.0g。将反应后的溶液稀释至1L,此时溶液中c(SO42-)=______mo/L,产生SO2体积(标准状况下)V(SO2)=______L;
(2)将(1)中产生的气体缓缓通入100mL a mo/L NaOH溶液中,SO2和NaOH都完全消耗,则a的取值范围为______。
【答案】5:4 铁钉表面被钝化(或其他合理答案) 2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O d 80% 检验SO2是否除尽 C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O d 80% 检验SO2是否除尽 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O c D中固体由黑色变红色和E中固体由白色变蓝色 1 4.48 2≤a≤4
CO2↑+2SO2↑+2H2O c D中固体由黑色变红色和E中固体由白色变蓝色 1 4.48 2≤a≤4
【解析】
I.根据转移电子及原子守恒配平方程式,从而确定a、b关系;
(1)根据浓硫酸的强氧化性及Fe被氧化产物的性质分析;
(2)铁与浓硫酸在加热时反应产生硫酸铁、二氧化硫和水;
(3)①亚铁离子有还原性,能还原酸性高锰酸钾溶液而使其褪色;
②气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,根据硫酸钡与二氧化硫的关系式计算二氧化硫的体积,再根据体积分数公式计算;
(4)二氧化硫能使品红溶液褪色,据此判断是否含有二氧化硫;
(5)碳素钢中含有碳,加热条件下,碳和浓硫酸反应生成二氧化碳;
(6)用澄清石灰水检验二氧化碳,首先要排除二氧化硫的干扰;
(7)Q1气体,在标准状况下,密度为0.0893g/L,其相对分子质量为2,所以是氢气,氢气检验还原性,能含有氧化铜同时生成水,水能使无水硫酸铜变蓝.
III.(1)硫酸完全反应,发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,Zn+H2SO4=ZnSO4+H2↑,结合方程式计算;
(2)SO2与NaOH反应产生的盐可能为NaHSO3、Na2SO3,也可能是二者的混合物,用极值法计算。
I. aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O中Cu元素化合价由0价变为+1价、+2价、S元素化合价由+6价变为-2价,转移电子数为6,根据转移电子守恒及原子守恒配平方程式为5Cu+4H2SO4
cCu2S+dCuSO4+eH2O中Cu元素化合价由0价变为+1价、+2价、S元素化合价由+6价变为-2价,转移电子数为6,根据转移电子守恒及原子守恒配平方程式为5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O,所以a:b=5:4;
Cu2S+3CuSO4+4H2O,所以a:b=5:4;
(1)中常温下,工业上用铁质容器盛放冷的浓硫酸,是由于浓硫酸具有强的氧化性,会将Fe表面氧化产生一层致密的氧化物薄膜,阻止金属的进一步反应,即产生钝化现象;
(2)在加热时,Fe与浓硫酸发生氧化还原反应,产生硫酸铁、二氧化硫和水,根据电子守恒、原子守恒,可得反应方程式:2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O;
Fe2(SO4)3+3SO2↑+6H2O;
(3)①因为有Fe3+的干扰,可以利用Fe2+具有还原性、可以被酸性KMnO4溶液氧化,发生氧化还原反应使高锰酸钾溶液褪色,故合理选项是d;
②气体Y通入足量溴水中,发生反应,SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,所以硫酸钡和二氧化硫之间的关系式为SO2~BaSO4,n(SO2)=n(BaSO4)=![]() =0.02mol,所以SO2气体的体积为V(SO2)=0.02mol×22.4L/mol=0.448l=448mL,所以二氧化硫的体积分数为(0.448mL÷560ml)×100%=80%;
=0.02mol,所以SO2气体的体积为V(SO2)=0.02mol×22.4L/mol=0.448l=448mL,所以二氧化硫的体积分数为(0.448mL÷560ml)×100%=80%;
(4)装置B中试剂是品红溶液,其作用是检验二氧化硫是否除尽;
(5)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(6)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫还能使品红溶液褪色,所以要检验二氧化碳必须排除二氧化硫的干扰,B装置是检验二氧化硫是否除尽,所以澄清石灰水应放置在B和C之间,即在通入碱石灰之前检验,故合理选项是c;
(7)Q1气体,在标准状况下,密度为0.0893g/L,则其摩尔质量为M=0.0893g/L×22.4L/mol=2g/mol,其相对分子质量为2,因此Q1为H2,氢气具有还原性,能将黑色的CuO生成红色的Cu单质,同时产生水,水能使无水硫酸铜变为蓝色,这是检验水的特征反应,乙醇若D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气;
III.(1) 一定质量的Zn与
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,Zn+H2SO4=ZnSO4+H2↑,
x 2x x x y y y
由题意可知:x+y=1;2x+y=1.2,解得x=0.2mol,y=0.8mol,因此将反应后的溶液稀释至1L,此时溶液中c(SO42-)=![]() =1mol/L,反应产生的SO2气体在标准状况下的体积V(SO2)=0.2mol×22.4L/mol=4.48L;
=1mol/L,反应产生的SO2气体在标准状况下的体积V(SO2)=0.2mol×22.4L/mol=4.48L;
(2) SO2与NaOH反应产生的盐可能为酸式盐NaHSO3,也可能为正盐Na2SO3,也可能是二者的混合物。若SO2与NaOH反应产生的盐若完全为NaHSO3,根据元素守恒可得n(NaOH)=n(SO2)=0.2mol,0.1L×amol/L=0.2mol,所以a=2mol/L;若完全为正盐Na2SO3,则n(NaOH)=2n(SO2)=0.4mol,0.1L×amol/L=0.4mol,所以a=4mol/L;若形成的盐既含有NaHSO3,也含有Na2SO3,则需要的NaOH溶液的物质的量浓度在2到4之间,即2≤a≤4。

【题目】前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
A | 2p能级电子半充满 |
B | 与A同周期,且原子核外有2个未成对电子 |
C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
D | 其基态原子外围电子排布为msnmpn+2 |
E | 前四周期元素中,E元素基态原子未成对电子数最多 |
F | 基态F+各能级电子全充满 |
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______种能量不同的电子,电子排布式为________________,写出F元素基态原子的价电子排布图________________。
(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为________。
(3)A、B、C、D四种元素:(用元素符号表示,下同)
①原子半径由小到大的顺序是___________________;
②第一电离能由大到小的顺序为__________________;
③电负性由大到小的顺序是____________________。
(4)判断下列分子或离子中空间构型是V形的是________(填写序号)。
a.SO2 b.H2O c.NO![]() d.NO
d.NO![]()
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究
①实验Ⅰ中生成红色物质的离子方程式为: __________________________________________
②请写出60s后反应进一步加快可能的原因(写出一条)________________________________________________________________
(2)对实验Ⅱ进行研究
①实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
②假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
③假设二:________________________________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
①实验Ⅵ的设计目的是:_______________________________________________
②其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________
③其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:________________________________
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
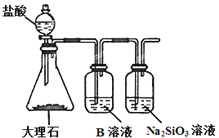
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。