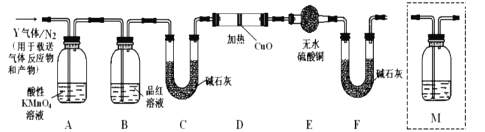
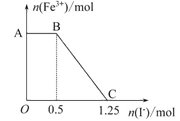
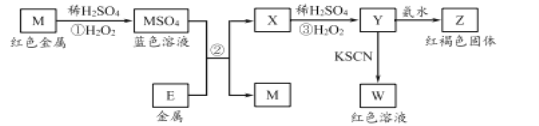
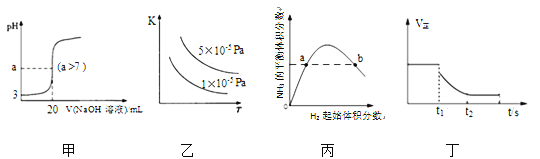
题目内容
【题目】下列叙述错误的是
A.根据盐酸能导电可判断:氯化氢为电解质
B.根据溶液显碱性可判断:纯碱属于碱类
C.根据是否有电子转移可判断:漂白粉在空气中久置失效,其中存在氧化还原反应
D.根据发挥漂白作用的物质性质推断:氯水和活性炭的漂白原理不同
【答案】B
【解析】
A.盐酸即氯化氢的水溶液,水溶液中能导电的化合物是电解质,A项正确;
B.纯碱属于盐类,B项错误;
C.有电子转移的反应即氧化还原反应,C项正确;
D.氯水是靠次氯酸的氧化性来漂白,活性炭靠吸附来漂白,D项正确;
答案选B。

练习册系列答案
相关题目