题目内容
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
二氧化碳 | 碳酸钠 | 转移的电子 | |
A | 1mol | NA | |
B | 22.4L | 1mol | |
C | 106 g | 1mol | |
D | 106g | 2NA |
A.AB.BC.CD.D
【答案】AC
【解析】
由化学方程式:2Na2O2+2CO2═2Na2CO3+O2,根据质量差求出二氧化碳、碳酸钠的物质的量,进而求出碳酸钠的质量和转移的电子数。
二氧化碳和过氧化钠反应,当固体质量增加28g时,设参与反应二氧化碳的物质的量为x,生成碳酸钠的物质的量为y,
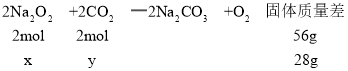
![]() =
=![]() ,解得:x=1mol,
,解得:x=1mol,![]() =
=![]() ,解得y=1mol,碳酸钠的质量=1mol×106g/mol=106g,因常温常压下发生的反应,1mol二氧化碳的体积>22.4L;由化学方程式可知:1mol二氧化碳参与反应转移1mol电子,即有NA个电子转移。
,解得y=1mol,碳酸钠的质量=1mol×106g/mol=106g,因常温常压下发生的反应,1mol二氧化碳的体积>22.4L;由化学方程式可知:1mol二氧化碳参与反应转移1mol电子,即有NA个电子转移。
答案选AC。

练习册系列答案
相关题目