题目内容
【题目】海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图. 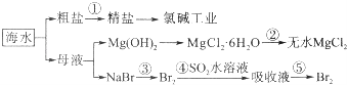
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣等离子.
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的 .
(2)除去粗盐溶液中的杂质(Mg2+、SO42﹣、Ca2+),加入药品的顺序可以为(填序号)
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl26H2O制得无水MgCl2 , 应如何操作 .
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将转化为的过程.采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为
(5)从第③步到第④步的目的是 . 采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收.主要反应的化学方程式为 .
【答案】
(1)HCO3﹣
(2)①②④③
(3)在氯化氢气流中加热至恒重
(4)电能;化学能;MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
(5)浓缩富集溴;Br2+SO2+2H2O=H2SO4+2HBr
【解析】解:海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣等离子,可分别加热氯化钡、氢氧化钠、碳酸钠,过滤后加入盐酸,结晶得到精盐,可用于氯碱工业;母液中含有镁离子,加入氢氧化钠得到氢氧化镁,加入盐酸得到氯化镁晶体,在盐酸氛围中加热得到无水氯化镁;溴化钠中通入氯气得到溴,用二氧化硫吸收得到亚硫酸钠,继续通入氯气,得到溴,
(1.)海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、HCO3﹣等离子,在这些离子中能发生水解的是CO32﹣、HCO﹣3离子,HCO3﹣+H2OH2CO3+OH﹣它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,
所以答案是:HCO3﹣;
(2.)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的顺序为:①②④⑤,
所以答案是:①②④③;
(3.)镁离子水解,应抑制其水解得到无水盐,所以利用MgCl26H2O制得无水氯化镁,应采取的措施是在HCl气流中脱水,抑制氯化镁水解,
所以答案是:在HCl气流中脱水,抑制氯化镁水解,加热至恒重;
(4.)电解原理分析,电解饱和食盐水是电能转化为化学能,采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式MgCl2 ![]() Mg+Cl2↑,
Mg+Cl2↑,
所以答案是:电能;化学能;MgCl2 ![]() Mg+Cl2↑;
Mg+Cl2↑;
(5.)溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩富集溴,采用“空气吹出法”从浓海水中吹出Br2 , 并用SO2吸收,溴单质和二氧化硫发生氧化还原反应生成硫酸和氢溴酸,发生反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,
所以答案是:浓缩富集溴;Br2+SO2+2H2O=H2SO4+2HBr.

