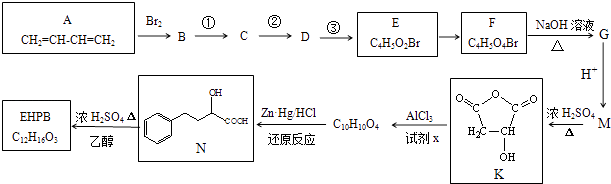
题目内容
【题目】甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]是常用的补铁剂,其合成方法如下: 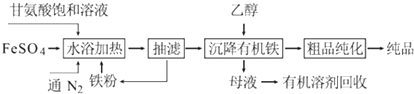
(1)通入N2的作用是 .
(2)已知甘氨酸显弱酸性,其结构简式为NH2CH2COOH,甘氨酸亚铁络合物易溶于水且在水中难电离,写出“水浴加热”过程中生成甘氨酸亚铁络合物的反应的离子方程式
(3)抽滤的好处是 , 从“母液”中回收有机溶剂的方法是 .
(4)“粗品纯化”的操作为蒸馏水洗涤、洗涤、干燥,其中干燥过程使用的设备最好选用(填“常压干燥机”或“真空干燥机”).
(5)有文献指出,若在“水浴加热”过程中投入适量的石灰石,则能同时提高产品的产率和纯度,请解释原因: .
(6)若甘氨酸的投料量为300kg,产出纯品346.8kg,则产率为 . (甘氨酸的相对分子质量为75)
【答案】
(1)防止Fe2+被氧气氧化或搅拌以加快化学反应速率
(2)2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑,NH2CH2COOH+Fe2+?(NH2CH2COO)2Fe+2H+
(3)加快过滤的速度;蒸馏
(4)无水乙醇(或丙酮等);真空干燥机
(5)石灰石消耗H+ , 使H+浓度降低,有利于反应向生成甘氨酸亚铁络合物的方向进行;同时,Ca2+与SO42﹣反应生成CaSO4沉淀,降低了杂质离子SO42﹣的浓度
(6)85%
【解析】解:(1)甘氨酸饱和溶液通入氮气,气流通过溶液,能起搅拌溶液的作用,搅拌以加快化学反应速率,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物,亚铁离子易被氧气氧化,氮气为保护气,通入氮气,防止Fe2+被氧气氧化, 所以答案是:防止Fe2+被氧气氧化或搅拌以加快化学反应速率;(2)甘氨酸显弱酸性,加入铁粉2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物,离子反应为:2NH2CH2COOH+Fe2+(NH2CH2COO)2Fe+2H+ ,
所以答案是:2NH2CH2COOH+Fe=(NH2CH2COO)2Fe+H2↑;2NH2CH2COOH+Fe2+(NH2CH2COO)2Fe+2H+;(3)抽滤是指用抽气泵使瓶中的压强降低,达到固液分离的目的,能加快过滤的速度,互溶的液体采用蒸馏的方法分离,所以采用蒸馏的方法从母液中回收有机物,
所以答案是:加快过滤的速度;蒸馏;(4)甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]为有机络合物,粗品纯化采用无水乙醇(或丙酮等)洗涤,有机物的沸点较低,采用真空干燥机能实现在低温条件下加热脱水干燥,所以选择真空干燥机干燥,
所以答案是:无水乙醇(或丙酮等);真空干燥机;(5)甘氨酸显弱酸性,其结构简式为NH2CH2COOH,投入适量的石灰石,石灰石消耗H+ , 使H+浓度降低,有利于反应2NH2CH2COOH+Fe2+(NH2CH2COO)2Fe+2H+ , 向生成甘氨酸亚铁络合物的方向进行,同时,Ca2+与SO42﹣反应生成CaSO4沉淀,降低了杂质离子SO42﹣的浓度,
所以答案是:石灰石消耗H+ , 使H+浓度降低,有利于反应向生成甘氨酸亚铁络合物的方向进行,同时,Ca2+与SO42﹣反应生成CaSO4沉淀,降低了杂质离子SO42﹣的浓度;(6)甘氨酸的投料量为300kg,甘氨酸的物质的量n= ![]() =4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为=
=4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为= ![]() ×100%=
×100%= ![]() =85%,
=85%,
所以答案是:85%.

【题目】提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法正确的是( )
不纯物质 | 除杂试剂 | 分离方法 | |
A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C | 苯(Br2) | KOH溶液 | 分液 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
A.A
B.B
C.C
D.D