题目内容
【题目】铁及其化合物在生活中有广泛应用。
(1)Fe2+基态的电子排布式为___。
(2)实验室用Fe3+检验苯酚。苯酚分子中碳原子的杂化方式为___。
(3)以Fe和BN为原料合成的铁氮化合物在光电子器材领域有广泛应用。
①以氨硼烷(NH3BH3)为原料可以获得BN。氨硼烷的结构式为___(配位键用“→”表示),氨硼烷易溶于水,其主要原因是___。
②以硼烷和氨气为原料可合成氨硼烷。NH3属于___分子(填“极性”或“非极性”)。
③如图为Fe与N所形成的一种化合物的基本结构单元,该化合物的化学式为___。

【答案】1s22s22p63s23p63d6或[Ar]3d6 sp2 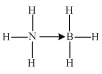 氨硼烷分子与水分子间存在氢键 极性 Fe4N
氨硼烷分子与水分子间存在氢键 极性 Fe4N
【解析】
(1)铁元素的原子序数为26,失去2个电子形成亚铁离子;
(2)苯酚分子中苯环上的6个碳原子的杂化方式为sp2杂化;
(3)①氨硼烷中氮原子提供一对共用电子对给硼原子形成配位键,氨硼烷中氮原子能与水分子间形成氢键;
②氨气分子的空间构型为三角锥形,结构不对称;
③由晶胞结构可知,铁原子位于顶点和面心,氮原子位于体心,由分摊法计算分子式。
(1)铁元素的原子序数为26,失去2个电子形成亚铁离子,根据原子核外电子排布规律可知,亚铁离子的基态核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6,故答案为1s22s22p63s23p63d6 或[Ar]3d6;
(2)苯酚分子中苯环上的6个碳原子的杂化方式为sp2杂化,故答案为:sp2;
(3)①氨硼烷中氮原子具有孤电子对,硼原子具有空轨道,氮原子能提供一对共用电子对给硼原子形成配位键,则氨硼烷的结构式为 ;氨硼烷中氮原子能与水分子间形成氢键,则氨硼烷能溶于水,故答案为:
;氨硼烷中氮原子能与水分子间形成氢键,则氨硼烷能溶于水,故答案为:  ;氨硼烷分子与水分子间存在氢键;
;氨硼烷分子与水分子间存在氢键;
②氨气分子的空间构型为三角锥形,结构不对称,属于极性分子,故答案为:极性;
③由晶胞结构可知,铁原子位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,氮原子位于体心,个数为1,则晶胞中铁原子和氮原子的数目之比为4:1,化学式为Fe4N,故答案为:Fe4N。
=4,氮原子位于体心,个数为1,则晶胞中铁原子和氮原子的数目之比为4:1,化学式为Fe4N,故答案为:Fe4N。

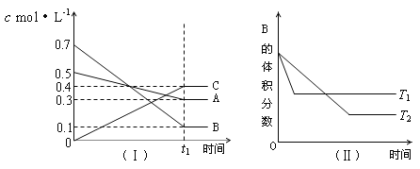
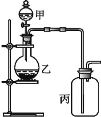
【题目】利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)( )
选项 | 实验目的 | 甲中物质 | 乙中物质 | 丙中物质 |
|
A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
C | 比较H2CO3和H2SiO3的酸性 | 稀硫酸溶液 | 碳酸钠 | 硅酸钠溶液 | |
D | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色 石蕊试纸 |
A.AB.BC.CD.D