题目内容
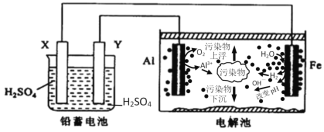
【题目】全固态锂硫电池是一种新型电池,其能量密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉。已知锂硫电池的总反应为![]() ,用此电池作电源电解足量的
,用此电池作电源电解足量的![]() 溶液,其工作原理如图所示。下列有关说法正确的是( )
溶液,其工作原理如图所示。下列有关说法正确的是( )

A.乙池溶液中的NO3![]() 移向铁电极
移向铁电极
B.乙池石墨电极反应式为![]()
C.甲池充电时,锂电极发生氧化反应
D.甲池中消耗14g锂,乙池中产生![]() 氧气
氧气![]() 标准状况下
标准状况下![]()
【答案】D
【解析】
A.甲为原电池,其中Li电极为负极,所连接的Fe电极为阴极,S电极为正极,所连接的C电极为阳极,电解池中![]() 移向阳极
移向阳极![]() 电极
电极![]() ,故A错误;
,故A错误;
B.石墨电极为阳极,其电极反应式为![]() ,故B错误;
,故B错误;
C.甲池充电时,Li电极为阴极,![]() 得电子发生还原反应,故C错误;
得电子发生还原反应,故C错误;
D.根据得失电子守恒有![]() ,甲池中消耗14g锂,乙池产生
,甲池中消耗14g锂,乙池产生![]() 的物质的量为
的物质的量为![]() ,故D正确。
,故D正确。

【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)如何判断滴定达到终点__________________________ 。
(2)该小组在步骤①中的错误是_________________ ,由此造成的测定结果_____________(填偏高、偏低或无影响);
(3)步骤②缺少的操作是__________________________;
(4)如图,是某次滴定时滴定管中的液面,其读数为_____________ mL

(5)根据下列数据:
滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
滴定前读(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
第三次 | 25.00 | 0.80 | 23.10 |
请选用合理的数据计算待测烧碱溶液的浓度为_____________ mol/L(保留到小数点后四位)
(6)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定前读数正确,滴定结束时俯视读数: