题目内容
【题目】有关电解质的说法正确的是
A.固体NaCl不导电,所以NaCl不是电解质
B.SO3水溶液的导电性很好,所以SO3是电解质
C.液态的铜导电性很好,所以铜是电解质
D.Na2O液态时能导电,所以Na2O是电解质
【答案】D
【解析】
A.固体NaCl不导电,但其水溶液能导电或熔融态能导电,所以是电解质,故A错误;
B.虽然三氧化硫的水溶液导电性很好,但溶液中的离子是硫酸电离的,所以三氧化硫不是电解质,故B错误;
C.铜是单质,不是电解质,也不是非电解质,故C错误;
D.氧化钠液态时能导电,离子是氧化钠电离产生的,所以是电解质,故D正确;
故答案为D。

【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是。
(2)该温度下,该反应的化学平衡常数是。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是。此时,该合成反应是否达到了平衡状态?(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。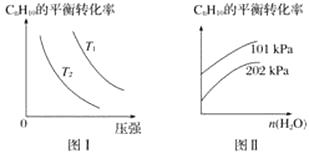
①由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是。



