题目内容
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下转化关系:(部分反应物、产物及反应条件已略去)。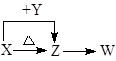
请回答下列问题:
(1)X与Y在水溶液中反应的离子方程式为 ;
(2)W的结构式为
(3)将Z装入圆底烧瓶,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅱ中的物质由短周期元素组成,装置Ⅲ中产生白色沉淀,装置Ⅴ 中可收集到一种能使带火星木条复燃的气体。装置Ⅱ中物质的化学键类型为 ;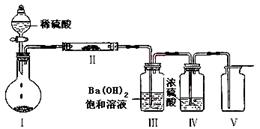
(4)下列关于X、Z的鉴别方法不正确的是
| A.分别加热X、Z的粉末,将产生的气体通入澄清石灰水,观察现象 |
| B.分别将X、Z配成稀溶液,逐滴滴加稀盐酸,观察现象 |
| C.分别将X、Z配成稀溶液,分别加入氯化钙溶液,观察现象 |
| D.分别将X、Z配成稀溶液,分别加入澄清石灰水,观察现象 |
(7分)(1)HCO3- + OH-= CO32- + H2O (2分) (2) O=C=O (1分)
(3)离子键、共价键 (2分) (4)D (2分)
解析试题分析:X、Y、Z的焰色反应均为黄色,说明均含有钠元素。因此根据转化关系可知,X是碳酸氢钠,Z是碳酸钠,Y是氢氧化钠。W为无色无味气体,所以W是CO2。
(1)X与Y在水溶液中反应的离子方程式为HCO3- + OH-= CO32- + H2O。
(2)CO2是直线型结构,其结构式是O=C=O。
(3)稀硫酸和碳酸钠反应生成CO2,又因为装置Ⅲ中产生白色沉淀,因此该沉淀应该是碳酸钡。装置Ⅴ中可收集到一种能使带火星木条复燃的气体,则该气体是氧气,所以装置Ⅱ中物质是过氧化钠。其中含有的化学键类型为离子键、共价键。
(4)A中碳酸钠受热不分解,碳酸氢钠加热分解生成CO2,CO2能使澄清的石灰水变混浊,所以可以鉴别;B中碳酸钠和盐酸的反应是分步进行的,首先生成碳酸氢钠和氯化钠。而碳酸氢钠立即和盐酸反应生成CO2气体,可以鉴别。C中碳酸氢钠和氯化钙不反应,而碳酸钠和氯化钙反应生成白色沉淀碳酸钙,可以鉴别。D中碳酸钠和碳酸氢钠都能和澄清石灰水反应生成白色沉淀碳酸钙,不能鉴别,答案选D。
考点:考查钠以及化合物结构、性质以及鉴别的有关判断
点评:该题是中等难度的试题,主要是考查学生读一钠及其化合物结构和性质,特别是有关转化的鉴别的熟悉了解程度,意在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣,也有助于培养学生的逻辑推理能力和规范实验设计能力。

 金博士一点全通系列答案
金博士一点全通系列答案 (2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
(2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.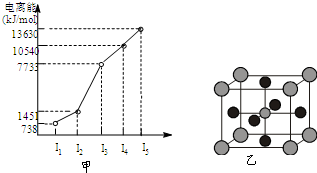 有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.
有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.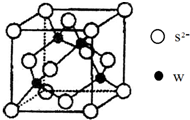 原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.
原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.