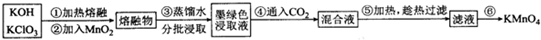题目内容
18.下列除杂质的操作中不正确的是( )| A. | Fe2O3中混有少量的Al2O3:加入过量烧碱溶液充分反应后过滤 | |
| B. | FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液 | |
| D. | SiO2固体中混有少量的铁粉:用磁铁将铁粉吸出 |
分析 A.氧化铝与烧碱反应,而氧化铁不能;
B.Fe与氯化铁反应生成氯化亚铁;
C.碳酸氢钠和NaOH反应生成碳酸钠和水,但引入新杂质水;
D.铁能被磁铁吸引,二氧化硅不能.
解答 解:A.氧化铝与烧碱反应,而氧化铁不能,则加入过量烧碱溶液充分反应后过滤可除杂,故A正确;
B.Fe与氯化铁反应生成氯化亚铁,则加入过量铁粉充分反应后过滤可除杂,故B正确;
C.碳酸氢钠和NaOH反应生成碳酸钠和水,但引入新杂质水,应利用加热法除去Na2CO3固体中混有少量NaHCO3,故C错误;
D.铁能被磁铁吸引,二氧化硅不能,则用磁铁将铁粉吸出可除杂,故D正确;
故选C.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-) (均用实际的元素符号表示).
比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bcd(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
d.BD2-的钠盐、G-的钠盐的外观及其相似,鉴别它们可以用酸性高锰酸钾溶液、酸性碘化钾淀粉溶液,也可以通过检测两溶液的PH值来鉴别.
| 元素性质[] | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-) (均用实际的元素符号表示).
比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bcd(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
d.BD2-的钠盐、G-的钠盐的外观及其相似,鉴别它们可以用酸性高锰酸钾溶液、酸性碘化钾淀粉溶液,也可以通过检测两溶液的PH值来鉴别.
6.A(g)+B(g)=C(g)△H=-Q1KJ/mol
D(g)+B(g)=E(g)△H=-Q2KJ/mol,
且Q1大于Q2,若A和D的混合气体1mol完全与B反应放出的热量为Q3KJ,则A与D的物质的量之比为( )
D(g)+B(g)=E(g)△H=-Q2KJ/mol,
且Q1大于Q2,若A和D的混合气体1mol完全与B反应放出的热量为Q3KJ,则A与D的物质的量之比为( )
| A. | (Q2-Q1):(Q1-Q3) | B. | (Q3-Q2):(Q1-Q3) | C. | (Q3-Q2):(Q3-Q1) | D. | (Q1-Q2):(Q3-Q1) |
13.下列物质中既能发生水解反应,又能催化加氢的是( )
| A. | 油酸甘油酯 | B. | 硬脂酸甘油酯 | C. | 油酸 | D. | 乙酸乙酯 |
10.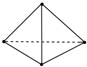 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )| A. | +882 kJ•mol-1 | B. | +441 kJ•mol-1 | C. | -882 kJ•mol-1 | D. | -441 kJ•mol-1 |
 短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题: ;
;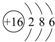 .
.