题目内容
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.60 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +2 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
根据上表回答下列问题:
(1)C、I的氢化物可相互混溶在一起,请解释其可能的原因
;
(2) 写出E的单质与I元素的最高价氧化物对应的水化物反应的化学方程式:
;
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式);元素E、H、I形成的化合物HEI,其电子式为
,该化合物中共形成 个σ键, 个π键;
(4)元素B、D、H与C组成的化合物B2C、DC、H2C的熔点高低顺序为 ,其原因是 ;
(5)A和J相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.氢化物中X—H键的键长(X代表A和J两元素) b.单质分子中的键能
c.两单质在自然界的存在 d.含氧酸的酸性
e.气态氢化物的稳定性和挥发性 f.两元素的电负性
(1)相似相溶,相互反应,形成氢键 (2分)
(2)C+4HNO3==CO2↑+4NO2↑+2H2O (2分)
(3)PCl3 或CCl4 Na+[]— 1 2 (4分)
(4)MgO>Na2O>K2O 离子半径越小,离子所带电荷数越多,晶格能越大,熔点越高
(5)硅 af
解析:略

 阅读快车系列答案
阅读快车系列答案(10分)下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素中原子序数最小的是: (填编号)。
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:
②H2C2与EC2反应: 。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式)。元素I、J形成的化合物可能是什么晶体 。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中含有的官能团
(5)C和I相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.气态氢化物的稳定性和挥发性 b. 单质分子中的键能
c. 两元素得电子能力 d .含氧酸的酸性
e .氢化物中X—H键的键长(X代表C和I两元素) f.两单质在自然界的存在
(12分)图表法、图象法是常用的科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B[ | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: (填编号)。比元素B原子序数大10的元素其基态原子的核外电子排布是
 。
。(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出一种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形
成
 个σ键, 个π键。
个σ键, 个π键。(4)短周期某主族元素K的电离能情况如图(A)所示。
则K元素位于周期表的第 族。
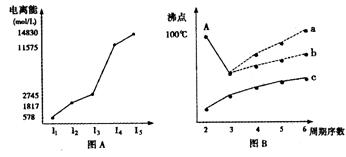
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是