题目内容
下表列出前20号元素中的某些元素性质的一些数据,试回答下列问题:
(1)以上10种元素中第一电离能最小的是:
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:
②H2C2与EC2反应:
(3)比元素B原子序数大5的元素基态原子电子排布式是
(4)C和I相比较,非金属性较弱的是
a.气态氢化物的稳定性和挥发性
b.单质分子中的键能
c.两元素的电负性
d.含氧酸的酸性
e.氢化物中X-H键的键长(X代表C和I两元素)
f.两单质在自然界的存在.
| 元素 性质 |
A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
B
B
(填编号).(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:
C+4HNO3═CO2+4NO2+2H2O
C+4HNO3═CO2+4NO2+2H2O
;②H2C2与EC2反应:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
.(3)比元素B原子序数大5的元素基态原子电子排布式是
1s22s22p63s23p63d54s1或[Ar]3d54s1
1s22s22p63s23p63d54s1或[Ar]3d54s1
.(4)C和I相比较,非金属性较弱的是
氮
氮
(填元素名称),可以验证你的结论的是下列中的ce
ce
(填编号).a.气态氢化物的稳定性和挥发性
b.单质分子中的键能
c.两元素的电负性
d.含氧酸的酸性
e.氢化物中X-H键的键长(X代表C和I两元素)
f.两单质在自然界的存在.
分析:根据最高正价=主族元素的族序数可知,B、H元素最高正价为+1价,因此可知二种元素为第ⅠA族元素,结合半径大小关系可知B为K元素,H为Na元素,A、C最低价为-2价,且C无正价,应为O元素,则A为S元素,F和I最低价都为-3价,应为周期表第ⅤA族元素,由半径大小可知I为N元素,F为P元素,E和J的最高正价为+4价,应为周期表第ⅣA族元素,E为C元素,J为Si元素,G的最高正价为+7价,且原子半径比A小,比C大,应为Cl元素,D最高正价为+3价,应为ⅢA族元素,原子半径比H小,比A大,应为 Al元素,结合对应单质化合物的性质以及题目要求解答该题.
解答:解:根据最高正价=主族元素的族序数可知,B、H元素最高正价为+1价,因此可知二种元素为第ⅠA族元素,结合半径大小关系可知B为K元素,H为Na元素,A、C最低价为-2价,且C无正价,应为O元素,则A为S元素,F和I最低价都为-3价,应为周期表第ⅤA族元素,由半径大小可知I为N元素,F为P元素,E和J的最高正价为+4价,应为周期表第ⅣA族元素,E为C元素,J为Si元素,G的最高正价为+7价,且原子半径比A小,比C大,应为Cl元素,D最高正价为+3价,应为ⅢA族元素,原子半径比H小,比A大,应为Al元素,
(1)电离能最小的元素应为金属性最强的元素,应为K,编号为B,故答案为:B;
(2)①E为C元素,I为N元素,对应的最高价氧化物的水化物为HNO3,二者反应的方程式为C+4HNO3═CO2+4NO2+2H2O,
故答案为:C+4HNO3═CO2+4NO2+2H2O;
②H2C2与EC2分别为Na2O2与CO2,二者反应的方程式为2Na2O2+2CO2═2Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)比元素B原子序数大5的元素为Cr元素,电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,
故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;
(4)E为C元素,I为N元素,为同周期元素,从左到右元素的非金属性逐渐增强,则非金属性N的较强,氢化物中,键长越长,键能越小,氢化物越不稳定,元素的非金属性越强,对应的氢化物越稳定,在最高价含氧酸的酸性越强,
故答案为:氮;ce.
(1)电离能最小的元素应为金属性最强的元素,应为K,编号为B,故答案为:B;
(2)①E为C元素,I为N元素,对应的最高价氧化物的水化物为HNO3,二者反应的方程式为C+4HNO3═CO2+4NO2+2H2O,
故答案为:C+4HNO3═CO2+4NO2+2H2O;
②H2C2与EC2分别为Na2O2与CO2,二者反应的方程式为2Na2O2+2CO2═2Na2CO3+O2,故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)比元素B原子序数大5的元素为Cr元素,电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,
故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;
(4)E为C元素,I为N元素,为同周期元素,从左到右元素的非金属性逐渐增强,则非金属性N的较强,氢化物中,键长越长,键能越小,氢化物越不稳定,元素的非金属性越强,对应的氢化物越稳定,在最高价含氧酸的酸性越强,
故答案为:氮;ce.
点评:本题考查原子结构与元素周期律知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握原子的结构特点和在周期表中的递变规律,为解答该题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(10分)下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素中原子序数最小的是: (填编号)。
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物反应:
②H2C2与EC2反应: 。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式)。元素I、J形成的化合物可能是什么晶体 。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中含有的官能团
(5)C和I相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.气态氢化物的稳定性和挥发性 b. 单质分子中的键能
c. 两元素得电子能力 d .含氧酸的酸性
e .氢化物中X—H键的键长(X代表C和I两元素) f.两单质在自然界的存在
(12分)图表法、图象法是常用的科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B[ | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: (填编号)。比元素B原子序数大10的元素其基态原子的核外电子排布是
 。
。(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出一种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形
成
 个σ键, 个π键。
个σ键, 个π键。(4)短周期某主族元素K的电离能情况如图(A)所示。
则K元素位于周期表的第 族。
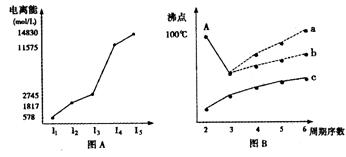
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是