��Ŀ����
����Ŀ������ͼʾ���Ӧ�������������
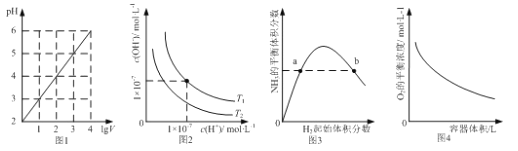
A. ͼ1��ʾ1LpH=2��CH3COOH��Һ��ˮϡ����VL��pH��1gV�ı仯
B. ͼ2��ʾ��ͬ�¶���ˮ��Һ��H+��OH-Ũ�ȵı仯�����ߣ�ͼ���¶�T1 ��T2
C. ͼ3��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ���������N2����ʼ���㶨���ı仯��ͼ��a��N2��ת����С��b��
D. ͼ4��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2BaO2��s��2BaO��s��+O2��g����O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
���𰸡�C
��������A��CH3COOH�����ᣬ��Һ�д��ڵ���ƽ�⣬���Լ�ˮϡ��ʱ����̶�������������Ũ���Ǽ�С�ģ�����Һ�������10����c(H+)���ܼ�СΪԭ����1/10������pHҲ��������1����A����B��ˮ�ĵ��������ȵģ����������¶ȣ��������H+��OH-Ũ����������ͼ���е��¶�ΪT1>T2������B������C����ͼ���֪��N2����ʼ���㶨ʱ����H2�������ӣ�N2��ת������������a��N2��ת����С��b�㣬��C��ȷ��D�����������������Сѹǿ��ƽ���������������ķ����ƶ�������ƽ�������ƶ���O2��ƽ��Ũ��������ģ�����D��������ȷ��ΪC��

��ϰ��ϵ�д�
 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
�����Ŀ