题目内容
(2011?连云港模拟)在由水电离产生的H+浓度为1×10-13mol?L-1的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、S2- ②Na+、AlO2-、Cl-、SO42- ③Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-⑥Fe3+、Ca2+、Cl-、NO3-.
①K+、Cl-、NO3-、S2- ②Na+、AlO2-、Cl-、SO42- ③Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-⑥Fe3+、Ca2+、Cl-、NO3-.
分析:由水电离产生的H+浓度为1×10-13mol?L-1的溶液,溶液为酸或碱溶液,离子之间不能结合生成水、气体、沉淀,不能发生氧化还原反应等,则能大量共存,以此来解答.
解答:解:由水电离产生的H+浓度为1×10-13mol?L-1的溶液,溶液为酸或碱溶液,
①酸性溶液中H+、NO3-、S2-发生氧化还原反应,则不能共存,故错误;
②酸溶液中H+、AlO2-结合生成沉淀,则不能共存,故错误;
③无论酸或碱溶液中该组离子之间不反应,能共存,故正确;
④HCO3-既能与酸反应又能与碱反应,一定不能共存,故错误;
⑤无论酸或碱溶液中该组离子之间不反应,能共存,故正确;
⑥碱溶液中,Fe3+、OH-结合生成沉淀,不能共存,故错误;
故选B.
①酸性溶液中H+、NO3-、S2-发生氧化还原反应,则不能共存,故错误;
②酸溶液中H+、AlO2-结合生成沉淀,则不能共存,故错误;
③无论酸或碱溶液中该组离子之间不反应,能共存,故正确;
④HCO3-既能与酸反应又能与碱反应,一定不能共存,故错误;
⑤无论酸或碱溶液中该组离子之间不反应,能共存,故正确;
⑥碱溶液中,Fe3+、OH-结合生成沉淀,不能共存,故错误;
故选B.
点评:本题考查离子的共存,明确习题中的信息是解答本题的关键,注意选项中的氧化还原为解答的难点,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目

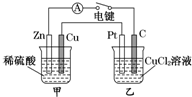 (2011?连云港模拟)某化学兴趣小组的同学用如图所示装置研究电化学问题.当闭合该装置的电键时,观察到电流计的指针发生偏转.下列有关说法不正确的是( )
(2011?连云港模拟)某化学兴趣小组的同学用如图所示装置研究电化学问题.当闭合该装置的电键时,观察到电流计的指针发生偏转.下列有关说法不正确的是( )