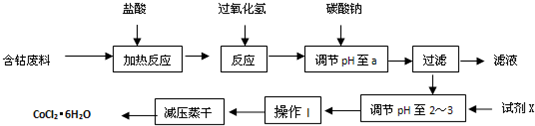
题目内容
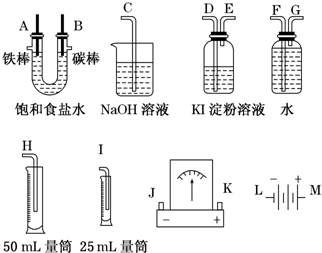
 (2011?连云港模拟)某化学兴趣小组的同学用如图所示装置研究电化学问题.当闭合该装置的电键时,观察到电流计的指针发生偏转.下列有关说法不正确的是( )
(2011?连云港模拟)某化学兴趣小组的同学用如图所示装置研究电化学问题.当闭合该装置的电键时,观察到电流计的指针发生偏转.下列有关说法不正确的是( )分析:A、依据装置图分析电极与电解质溶液可知电极活泼性相差大的为原电池,甲池为原电池,乙池为电解池;
B、依据电极反应和电子守恒计算分析;
C、甲池中氢离子在铜电极得到电子生成氢气,溶液中氢离子浓度减小,溶液pH增大;
D、乙中C电极和原电池负极连接做电解池的阴极,换做铜对电解过程无影响,不能形成电镀装置,电镀装置是阳极为镀层金属.
B、依据电极反应和电子守恒计算分析;
C、甲池中氢离子在铜电极得到电子生成氢气,溶液中氢离子浓度减小,溶液pH增大;
D、乙中C电极和原电池负极连接做电解池的阴极,换做铜对电解过程无影响,不能形成电镀装置,电镀装置是阳极为镀层金属.
解答:解:A、Zn、Cu电极和稀硫酸构成原电池,其中Zn作负极,Cu作正极;乙装置是电解池,C为阴极,Pt为阳极,故A正确;
B、当甲中产生0.1 mol H2时,电极反应无味2H++2e-═H2↑,电路转移0.2 mol 电子,乙中电解池中,阴极上 电极反应为Cu2++2e-═Cu,依据电子守恒计算得到0.1 mol Cu,质量为6.4 g,故B正确;
C、实验一段时间后,甲烧杯的溶液中c(H+)减小,pH增大,故C正确;
D、乙中的C电极是阴极,将其换成铜电极,该装置不是电镀装置,故D错误.
故选:D.
B、当甲中产生0.1 mol H2时,电极反应无味2H++2e-═H2↑,电路转移0.2 mol 电子,乙中电解池中,阴极上 电极反应为Cu2++2e-═Cu,依据电子守恒计算得到0.1 mol Cu,质量为6.4 g,故B正确;
C、实验一段时间后,甲烧杯的溶液中c(H+)减小,pH增大,故C正确;
D、乙中的C电极是阴极,将其换成铜电极,该装置不是电镀装置,故D错误.
故选:D.
点评:本题考查了原电池和电解池原理的分析应用,电极反应和电极判断,电子守恒的计算应用是解题关键,题目难度中等.

练习册系列答案
相关题目