题目内容
(2011?连云港模拟)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示.下列说法正确的是( )
| ||||||||||||||||||
分析:由元素在周期表的位置可知,Y为O元素、W为S元素、X为N元素、Z为Al元素;
A、Z为Al元素,处于第三周期第ⅢA族;
B、同周期自左而右原子半径减小,电子层越多原子半径越大;
C、氧元素的氢化物有H2O2;
D、核外电子数=质子数-所带电荷,根据核外电子排布规律判断电子层.
A、Z为Al元素,处于第三周期第ⅢA族;
B、同周期自左而右原子半径减小,电子层越多原子半径越大;
C、氧元素的氢化物有H2O2;
D、核外电子数=质子数-所带电荷,根据核外电子排布规律判断电子层.
解答:解:由元素在周期表的位置可知,Y为O元素、W为S元素、X为N元素、Z为Al元素;
A、Z为Al元素,处于第三周期第ⅢA族,故A错误;
B、同周期自左而右原子半径减小,电子层越多原子半径越大,所以原子半径的大小顺序为:rZ>rW>rX>rY,故B错误;
C、氧元素的氢化物有H2O2,故C错误;
D、O2-和Al3+核外电子数都是10,电子层数都是2,故D正确;
故选D.
A、Z为Al元素,处于第三周期第ⅢA族,故A错误;
B、同周期自左而右原子半径减小,电子层越多原子半径越大,所以原子半径的大小顺序为:rZ>rW>rX>rY,故B错误;
C、氧元素的氢化物有H2O2,故C错误;
D、O2-和Al3+核外电子数都是10,电子层数都是2,故D正确;
故选D.
点评:本题考查元素周期表、结构性质与位置关系等,难度不大,熟练掌握元素周期表的结构.

练习册系列答案
相关题目
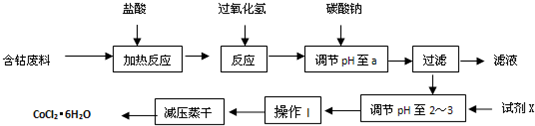
 (2011?连云港模拟)某化学兴趣小组的同学用如图所示装置研究电化学问题.当闭合该装置的电键时,观察到电流计的指针发生偏转.下列有关说法不正确的是( )
(2011?连云港模拟)某化学兴趣小组的同学用如图所示装置研究电化学问题.当闭合该装置的电键时,观察到电流计的指针发生偏转.下列有关说法不正确的是( )