题目内容
(2011?连云港模拟)请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生氢气的体积(大于25mL),并检验氯气的氧化性.
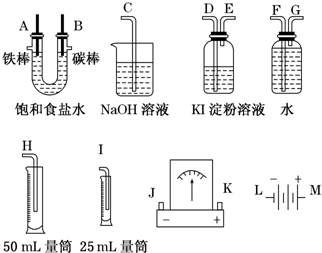
(1)A极发生的电极反应式是
B极发生的电极反应式是
电解饱和食盐水的化学方程式
(2)电源、电流表与A、B两极的正确连接顺序为:
L→
(3)设计上述气体实验装置时,各接口的正确连接顺序为:
(4)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为
(5)已知饱和食盐水50mL,某时刻测得H2体积为5.6mL(标准状况).此时溶液pH约为

(1)A极发生的电极反应式是
2H++2e-═H2↑
2H++2e-═H2↑
,B极发生的电极反应式是
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
.电解饱和食盐水的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(2)电源、电流表与A、B两极的正确连接顺序为:
L→
A
A
→B
B
→J
J
→K
K
→M.(3)设计上述气体实验装置时,各接口的正确连接顺序为:
H
H
接F
F
、G
G
接A、B接D
D
、E
E
接C
C
.(4)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为
Cl2+2I-═2Cl-+I2
Cl2+2I-═2Cl-+I2
.(5)已知饱和食盐水50mL,某时刻测得H2体积为5.6mL(标准状况).此时溶液pH约为
12
12
.分析:(1)要用铁棒和碳棒作电解电解氯化钠溶液制取氢气,则铁作阴极,碳棒作正极,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气;
(2)电源负极接电解池的铁棒、碳棒接电流计“-”端,“+”端接电源正极;
(3)用碘化钾溶液检验氯气的氧化性,用氢氧化钠溶液处理氯气的尾气;用排水法收集氢气,用50mL量筒盛放排出的水,注意导气管遵循“长进短出”原则;
(4)氯气具有强氧化性,能和碘离子发生置换反应;
(5)根据氢气和氢氧化钠的关系是计算氢氧化钠的物质的量,再根据c=
计算氢氧化钠浓度,再结合离子积常数计算氢离子浓度,从而得出溶液的pH.
(2)电源负极接电解池的铁棒、碳棒接电流计“-”端,“+”端接电源正极;
(3)用碘化钾溶液检验氯气的氧化性,用氢氧化钠溶液处理氯气的尾气;用排水法收集氢气,用50mL量筒盛放排出的水,注意导气管遵循“长进短出”原则;
(4)氯气具有强氧化性,能和碘离子发生置换反应;
(5)根据氢气和氢氧化钠的关系是计算氢氧化钠的物质的量,再根据c=
| n |
| V |
解答:解:(1)要用铁棒和碳棒作电解电解氯化钠溶液制取氢气,则铁作阴极,碳棒作正极,阴极铁上氢离子得电子发生还原反应,电极反应式为2H++2e-═H2↑,阳极碳棒上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-═Cl2↑,同时溶液中还产生氢氧化钠,所以电池反应式为 2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2H++2e-═H2↑;2Cl--2e-═Cl2↑;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)电源负极接电解池的铁棒、碳棒接电流计“-”端,“+”端接电源正极,所以其连接顺序是A B J K,
故答案为:A;B;J;K;
(3)电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,相应装置的作用: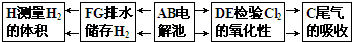 所以其连接顺序是:H←F←G←A,B→D→E→C,
所以其连接顺序是:H←F←G←A,B→D→E→C,
故答案为:H;F;G;D;E;C;
(4)氯气具有强氧化性,能和碘离子发生置换反应生成氯离子和碘,离子反应方程式为Cl2+2I-═2Cl-+I2,
故答案为:Cl2+2I-═2Cl-+I2;
(5)根据2NaCl+2H2O
2NaOH+H2↑+Cl2↑中氢氧化钠和氢气的关系式知,n(NaOH)=
×2=5.0×10-4 mol,
根据原子守恒得n(OH-)=5.0×10-4 mol,c(OH-)=(5.0×10-4 mol)÷(50×10-3 L)=10-2 mol/L,c(H+)=
=
mol/L=10-12 mol/L,pH=-lg10-12=12,
故答案为:12.
| ||
故答案为:2H++2e-═H2↑;2Cl--2e-═Cl2↑;2NaCl+2H2O
| ||
(2)电源负极接电解池的铁棒、碳棒接电流计“-”端,“+”端接电源正极,所以其连接顺序是A B J K,
故答案为:A;B;J;K;
(3)电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,相应装置的作用:
 所以其连接顺序是:H←F←G←A,B→D→E→C,
所以其连接顺序是:H←F←G←A,B→D→E→C,故答案为:H;F;G;D;E;C;
(4)氯气具有强氧化性,能和碘离子发生置换反应生成氯离子和碘,离子反应方程式为Cl2+2I-═2Cl-+I2,
故答案为:Cl2+2I-═2Cl-+I2;
(5)根据2NaCl+2H2O
| ||
| ||
| 1 |
根据原子守恒得n(OH-)=5.0×10-4 mol,c(OH-)=(5.0×10-4 mol)÷(50×10-3 L)=10-2 mol/L,c(H+)=
| 10-14 |
| c(OH-) |
| 10-14 |
| 0.02 |
故答案为:12.
点评:本题以电解原理为载体考查了气体的制取、性质的检验等知识点,根据电解原理、物质的性质、物质间的关系等来分析解答即可,难点是仪器连接顺序,根据气体制取装置→检验装置→收集装置→尾气处理装置来排序即可,难度中等.

练习册系列答案
相关题目
 (2011?连云港模拟)某化学兴趣小组的同学用如图所示装置研究电化学问题.当闭合该装置的电键时,观察到电流计的指针发生偏转.下列有关说法不正确的是( )
(2011?连云港模拟)某化学兴趣小组的同学用如图所示装置研究电化学问题.当闭合该装置的电键时,观察到电流计的指针发生偏转.下列有关说法不正确的是( )