题目内容
【题目】向0.1mol·L-1的 NH4HCO3溶液中逐渐加入0.1mol·L-1NaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量与起始物质的量比值)。根据图像,下列说法不正确的是
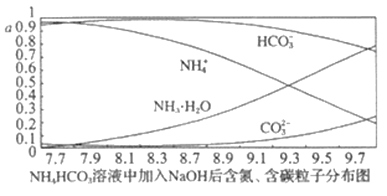
A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-=HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3·H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH===(NH4)2CO3+Na2CO3
【答案】D
【解析】
试题NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2O![]() HN3H2O+H+①;HCO3-的水解平衡,即HCO3-+H2O
HN3H2O+H+①;HCO3-的水解平衡,即HCO3-+H2O![]() H2CO3+OH-②;HCO3-的电离平衡,即HCO3-
H2CO3+OH-②;HCO3-的电离平衡,即HCO3-![]() H++CO32-③;A.在未加氢氧化钠时,溶液的pH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加,即逆方向的反应是H2CO3+OH-═HCO3-+H2O,故A正确;B.对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3H2O的量增加,NH4+被消耗,当pH大于8.7以后,CO32-的量在增加,平衡③受到影响,HCO3-被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,故B正确;C.从图中可直接看出pH=9.5时,溶液中c(HCO3-)>c(HN3H2O)>c(NH4+)>c(CO32-),故C正确;D.滴加氢氧化钠溶液时,HCO3-的量并没减小,反而增大,说明首先不是HCO3-与OH-反应,而是NH4+先反应,即NH4HCO3+NaOH═NaHCO3+NH3H2O,故D错误;故选D。
H++CO32-③;A.在未加氢氧化钠时,溶液的pH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加,即逆方向的反应是H2CO3+OH-═HCO3-+H2O,故A正确;B.对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3H2O的量增加,NH4+被消耗,当pH大于8.7以后,CO32-的量在增加,平衡③受到影响,HCO3-被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,故B正确;C.从图中可直接看出pH=9.5时,溶液中c(HCO3-)>c(HN3H2O)>c(NH4+)>c(CO32-),故C正确;D.滴加氢氧化钠溶液时,HCO3-的量并没减小,反而增大,说明首先不是HCO3-与OH-反应,而是NH4+先反应,即NH4HCO3+NaOH═NaHCO3+NH3H2O,故D错误;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如图 a、b、c、d均为铂电极,供选择的电解质溶液如下表。要满足条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则应选用的电解液是
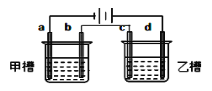
组 | A | B | C | D |
甲槽 | KCl | NaCl | NaOH | Cu(NO3)2 |
乙槽 | AgNO3 | NaNO3 | CuSO4 | NaCl |
A. A B. B C. C D. D


