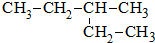题目内容
20.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+中的几种阳离子.(1)不做任何实验就可以判断原溶液中肯定不存在的离子是Cu2+.
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定存在的离子是Ag+,有关反应的离子方程式为Ag++Cl-═AgCl↓
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是Mg2+.
(4)原溶液中可能大量存在的阴离子是B(填字母).
A.Cl- B.N C.C D.OH-.
分析 (1)Cu2+有颜色;
(2)AgCl为不溶于稀硝酸的白色沉淀;
(3)加入过量NaOH溶液,出现白色沉淀,应为Mg(OH)2;
(4)NO3-与Ag+、Mg2+、Cu2+不生成沉淀,能共存.
解答 解:(1)由于溶液呈无色透明,而Cu2+有颜色,为蓝绿色,可以肯定原溶液中不存在Cu2+,故答案为:Cu2+;
(2)过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有Ag+离子,反应的离子方程式为Ag++Cl-═AgCl↓,
故答案为:Ag+;Ag++Cl-═AgCl↓;
(3)在除去Ag+离子的溶液中,加入过量NaOH溶液,出现白色沉淀,则原溶液中一定存在Mg2+,
故答案为:Mg2+;
(4)由于Cl-和Ag+离子,CO32-、OH-与Mg2+、Cu2+都能生成沉淀,只有NO3-与Ag+、Mg2+、Cu2+不生成沉淀,故原溶液中可能大量存在的阴离子是NO3-,
故答案为:B.
点评 本题主要考查了离子的检验和离子共存问题,注意常见离子的性质和检验方法是解答的关键,题目难度中等.

练习册系列答案
相关题目
10.如图是制备和研究乙炔性质的实验装置图,有关说法正确的是( )
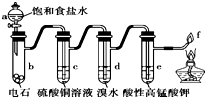

| A. | 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净 | |
| B. | c(过量)的作用是除去影响后续实验的杂质 | |
| C. | d、e褪色原理相同 | |
| D. | f处产生明亮的蓝色火焰 |
11.报载,2000年11月吉林省辽源矿物局所属一煤矿发生一起重大瓦斯(甲烷和空气的混合物)爆炸事故,造成人员伤亡.在煤矿的矿井里,除了必须采取安全措施,如通风、严禁烟火等外,还要随时检测瓦斯的体积分数.当空气中含甲烷的体积分数为5%~15%时,点燃就会发生爆炸,那么发生强烈爆炸时空气中(氧气的体积分数为21%)甲烷所占的体积分数是( )
| A. | 15% | B. | 10.05% | C. | 9.5% | D. | 5% |
15.下列变化中需加入氧化剂才能实现的是( )
| A. | H2S→SO2 | B. | Fe2+→Fe | C. | CO${\;}_{3}^{2-}$→CO2 | D. | 2H+→H2 |
12.下列叙述正确的是( )
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 含金属元素的离子不一定都是阳离子 | |
| C. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原时一定得到金属单质 |
9.下列各组比较中,前者比后者大的是( )
| A. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| B. | 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 | |
| C. | 25℃时,同浓度的NaCl溶液和氨水的导电能力 | |
| D. | 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 |