题目内容
16.已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E,其中A、C同周期,B、C同主族.A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成四个核10个电子的分子.试回答下列问题:(1)写出下列元素的名称:ANa、CS、EH.
(2)写出下列物质的电子式,D形成的单质分子:
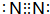 、C和E形成的化合物
、C和E形成的化合物 、A、B和E形成的化合物
、A、B和E形成的化合物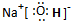 .
.
分析 五种短周期元素的原子序数的大小顺序为C>A>B>D>E.A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30,则离子含有的电子数为10,由A2B可知,A离子为+1价离子,B离子为-2价离子,则A为钠元素,B为氧元素;B、C同主族,则C为硫元素;D和E可形成四核10电子分子,则D为氮元素,E为氢元素.
解答 解:五种短周期元素的原子序数的大小顺序为C>A>B>D>E.A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30,则离子含有的电子数为10,由A2B可知,A离子为+1价离子,B离子为-2价离子,则A为钠元素,B为氧元素;B、C同主族,则C为硫元素;D和E可形成四核10电子分子,则D为氮元素,E为氢元素.
(1)由上述分析可知,A为Na元素、C为S元素、E为H元素,故答案为:Na;S;H;
(2)D为氮元素,单质中氮原子之间形成3对共用电子对,电子式为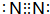 ,C和E形成的化合物为H2S,电子式为
,C和E形成的化合物为H2S,电子式为 ,A、B和E形成的化合物为NaOH,电子式为:
,A、B和E形成的化合物为NaOH,电子式为: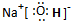 ,
,
故答案为: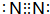 ;
; ;
;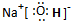 .
.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对电子式的考查,难度不大,注意基础知识的掌握与运用.

练习册系列答案
相关题目
7.Al(OH)3溶度积Ksp为1.6×-33,则0.2mol•L-1AlCl3溶液不产生沉淀的最大OH-物质的量浓度(mol•L)为( )
| A. | 1.9×-33 | B. | 2.0×10-11 | C. | 8.0×10-33 | D. | 2.5×10-5 |
4.将浓度为0.1mol•L-1HF溶液加水不断稀释,下列说法正确的是( )
| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大、c(HF)减小,则$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$增大 | |
| C. | 稀释过程中,c(OH-)、$\frac{c({H}^{+})}{c(HF)}$均增大 | |
| D. | 溶液的KW、$\frac{c({F}^{-})}{c({H}^{+})}$、pH均不变 |
11.下表是元素周期表的一部分,据此请回答下列问题.
(1)化学性质最不活泼的是(填元素符号,下同)He,金属性最强的是Na,非金属性最强的是F,电负性最大的是F,第一电离能最小的是Na;
(2)A、B、C、G四种元素的最高价氧化物对应水化物,其中碱性最强的是NaOH(填化学式,下同),属于两性氢氧化物的是Al(OH)3,酸性最强的是HClO4;
(3)第3周期各元素中,属于金属元素且原子半径最小的是Al(填元素符号,下同),熔点最低的是Na,还原性最强的是Na;
(4)E元素的氢化物是H2O(填化学式),该氢化物在常温下跟A单质发生反应的化学方程式是2Na+2H2O=2NaOH+H2↑,所得溶液的pH>7;(填“<”“>”或“=”)
(5)G元素和A元素形成的化合物属于离子晶体.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |
(2)A、B、C、G四种元素的最高价氧化物对应水化物,其中碱性最强的是NaOH(填化学式,下同),属于两性氢氧化物的是Al(OH)3,酸性最强的是HClO4;
(3)第3周期各元素中,属于金属元素且原子半径最小的是Al(填元素符号,下同),熔点最低的是Na,还原性最强的是Na;
(4)E元素的氢化物是H2O(填化学式),该氢化物在常温下跟A单质发生反应的化学方程式是2Na+2H2O=2NaOH+H2↑,所得溶液的pH>7;(填“<”“>”或“=”)
(5)G元素和A元素形成的化合物属于离子晶体.
1.在容积可变的容器中发生的化学反应mA(g)+nB(g)?pC(s)+qD(g)在一定温度和不同压强下达到平衡时分别得到D物质的量浓度如下表所示:
根据表格中的数据,下列判断正确的是( )
| 压强/kPa | 2 | 5 | 10 | 12 |
| C(D)/mol•L- | 0.08 | 0.20 | 0.40 | 0.48 |
| A. | 当压强增大时平衡向左移动 | B. | m+n>q | ||
| C. | 增加压强,平衡常数增大 | D. | 平衡不随着压强的变化移动 |
8.还原沉淀法是处理含铬(Cr2O72-和CrO42-)废水常用方法,过程如下:
CrO42-$\stackrel{H+}{→}$Cr2O72-$\stackrel{Fe_{2}+}{→}$Cr3+$\stackrel{OH-}{→}$Cr(OH)3
已知废水中Cr的含量为26.0g•L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32.有关叙述中不正确的是( )
CrO42-$\stackrel{H+}{→}$Cr2O72-$\stackrel{Fe_{2}+}{→}$Cr3+$\stackrel{OH-}{→}$Cr(OH)3
已知废水中Cr的含量为26.0g•L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32.有关叙述中不正确的是( )
| A. | 上述三个转化中只有一个涉及氧化还原反应 | |
| B. | 第二步离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+ | |
| C. | 处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水 | |
| D. | 当pH≥5时,废水中铬元素沉淀完全 |
5.下列有关化学用语正确的是( )
| A. | 乙醛的结构简式为CH3COH | B. | 乙烷的结构简式为:CH3CH3 | ||
| C. | 羟基的电子式为[:O:H]- | D. | 氯离子的结构示意图为: |
6.一定条件下,反应A+2B=2C,若用物质B表示的速率是1mol/(L?s),则相同条件下用物质A表示的速率是( )
| A. | 1mol/(L?s) | B. | 2mol/(L?min) | C. | 2mol/(L?s) | D. | 0.5mol/(L?s) |