题目内容
11.下列溶液中溶质的物质的量浓度为l mol/L的是( )| A. | 将40 g NaOH固体溶解于1 L水中 | |
| B. | 将22.4 L氯化氢气体溶于水配成l L溶液 | |
| C. | 将l L 10 mol/L的浓盐酸与9 L水混合 | |
| D. | 20 g NaOH固体溶解在水中配成500 mL溶液 |
分析 A、c=$\frac{\frac{m}{M}}{V}$=$\frac{m}{MV}$中,体积指溶液体积不是溶剂体积.
B、根据温度、压强对气体摩尔体积的影响分析判断.
C、根据不同液体混合时体积能否直接加和判断.
D、20 g NaOH的物质的量为0.5mol,据此计算即可.
解答 解:A、公式中V(体积)指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误.
B、气体摩尔体积受温度和压强的影响,温度越高,气体摩尔体积越大,标况下,22.4LHCl的物质的量是1mol,常温常压下,22.4LHCl的物质的量小于1mol,所以常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液的物质的量浓度不是1mol/L,故B错误.
C、1L10mol/L的浓盐酸与9L水混合配成溶液的体积不是10L,所以混合后溶液的物质的量浓度不是1mol/L,故C错误.
D、20 g NaOH的物质的量=$\frac{20g}{40g/mol}$=0.5mol,溶液的体积=0.5L,故浓度=$\frac{0.5mol}{0.5L}$=1mol/L,故D正确,故选D.
点评 本题考查了有关物质的量浓度的问题,难度不大,注意溶液的浓度有均一性,与取出溶液的体积大小无关.

练习册系列答案
相关题目
1.下列鉴别方法可行的是( )
| A. | 用NH3•H2O溶液鉴别Al3+、Mg2+和Ag+ | |
| B. | 用水鉴别乙醇、甲苯和溴苯 | |
| C. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- | |
| D. | 用澄清石灰水鉴别CO、CO2、SO2 |
6.下列有关反应的颜色变化中,不正确的是( )
| A. | 盐酸能使酚酞试液变红 | B. | 氯水久置后黄绿色消失 | ||
| C. | SO2使品红溶液褪色 | D. | 淀粉溶液遇碘单质变蓝 |
16.下列事实对应的离子方程式书写正确的是( )
| A. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 纯碱溶液能清洗油污:CO32-+2H2O?H2CO3+2OH- | |
| D. | 将过量的铁粉加入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O |
3.某温度下,在固定容积容器中,可逆反应A(g)+3B(g)?2C(g)达到平衡,此时测得n(A):n(B):n(C)=2:2:1.若保持温度不变,以n(A):n(B):n(C)=2:2:1的比例向该容器中再充入A、B和C,则( )
| A. | 平衡向正反应方向移动 | B. | 平衡向逆反应方向移动 | ||
| C. | 平衡不发生移动 | D. | 相对原平衡n(A)、n(B)减少,n(C)增大 |
8.在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g) 已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 生成l mol C的同时生成l mol D | D. | 气体的总物质的量 |

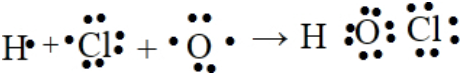 .
. .
.