题目内容
2.写出下列微粒的形成过程NaOH

HClO
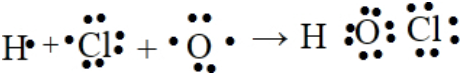 .
.
分析 氢氧化钠为离子化合物,是钠离子与氢氧根离子通过离子键结合而成,氧原子与氢原子通过共价键结合;
次氯酸是共价化合物,氧化子与氢原子、氯原子通过共用电子对形成共价键,据此解答.
解答 解:氢氧化钠为离子化合物,是钠离子与氢氧根离子通过离子键结合而成,氧原子与氢原子通过共价键结合,用电子式表示该物质的形成过程为: ;
;
次氯酸是共价化合物,氧化子与氢原子、氯原子通过共用电子对形成共价键,用电子式表示该物质的形成过程为: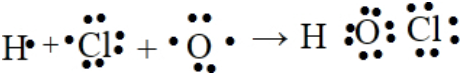 ;
;
故答案为: ;
;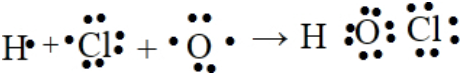 .
.
点评 本题考查了电子式的书写,明确物质所含化学键类型是解题关键,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
12.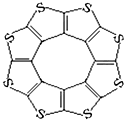 最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.
最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.
①元素电负性大小关系是:C<S(填“>”、“=”或“<”).
②分子中C原子的杂化轨道类型为sp2.
③有关键长数据如下:
从表中数据可以看出,C16S8中碳硫键键长介于C-S与C=S之间,原因可能是:分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质.
④C16S8与H2微粒间的作用力是范德华力.
 最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.
最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子.①元素电负性大小关系是:C<S(填“>”、“=”或“<”).
②分子中C原子的杂化轨道类型为sp2.
③有关键长数据如下:
| C-S | C=S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
④C16S8与H2微粒间的作用力是范德华力.
17.1mol某烃最多能和2molHCl发生加成反应,生成1mol氯代烷,1mol此氯代烷能和8molCl2发生取代反应,生成只含碳元素和氯元素的氯代烷,该烃可能是( )
| A. | CH3CH=CH2 | B. | CH2=CHCH=CH2 | C. | CH3=CHCH3 | D. | CH3-C≡CH2-CH3 |
7.氧化还原反应的实质是( )
| A. | 分子中的原子重新组合 | B. | 氧元素的得失 | ||
| C. | 电子的得失或共用电子对的偏移 | D. | 化合价的升降 |
14.2015年2月28日,央视原记者柴静及其团队制作的视频《穹顶之下》引起了人们对环境保护的再思考,下列说法体现人与自然和谐相处的是( )
| A. | 将聚氯乙烯等塑料垃圾焚烧 | |
| B. | 推广矿物燃料脱硫技术以减少SO2等有害气体的排放 | |
| C. | 大力开采石油、煤、页岩气(主要成分为CH4)等化石燃料 | |
| D. | 电池使用后随意丢弃,无需处理 |
11.下列溶液中溶质的物质的量浓度为l mol/L的是( )
| A. | 将40 g NaOH固体溶解于1 L水中 | |
| B. | 将22.4 L氯化氢气体溶于水配成l L溶液 | |
| C. | 将l L 10 mol/L的浓盐酸与9 L水混合 | |
| D. | 20 g NaOH固体溶解在水中配成500 mL溶液 |

 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见氧化物,气体E是单质F所含元素的氢化物.