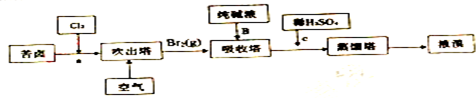
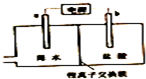
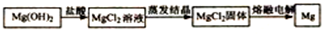题目内容
6.下列有关反应的颜色变化中,不正确的是( )| A. | 盐酸能使酚酞试液变红 | B. | 氯水久置后黄绿色消失 | ||
| C. | SO2使品红溶液褪色 | D. | 淀粉溶液遇碘单质变蓝 |
分析 A.酚酞变色范围为8-10;
B.氯气和水发生反应Cl2+H2O?H++Cl-+HClO,HClO不稳定,光照易分解生成HCl和氧气;
C.二氧化硫能和有色物质反应生成无色物质而具有漂白性;
D.淀粉遇碘变蓝色是淀粉的特征反应.
解答 解:A.酚酞变色范围为8-10,常温下盐酸溶液pH<7,所以盐酸不能使酚酞试液变红色,故A错误;
B.氯气和水发生反应Cl2+H2O?H++Cl-+HClO,HClO不稳定,光照易分解生成HCl和氧气,从而促进氯气和水反应,则氯水久置后黄绿色消失,故B正确;
C.二氧化硫能和有色物质反应生成无色物质而具有漂白性,所以二氧化硫和品红溶液反应生成无色物质而导致品红褪色,故C正确;
D.淀粉遇碘变蓝色是淀粉的特征反应,所以可以用淀粉试液检验碘单质,故D正确;
故选A.
点评 本题考查元素化合物,侧重考查物质性质的特殊性,注意二氧化硫漂白性和次氯酸漂白性区别,知道酸碱指示剂变色范围,题目难度不大.

练习册系列答案
相关题目
16.a、b、c三种元素,a、b同周期,a、c同主族,它们原子的最外层电子数之和为16,则这三种元素可能是
( )
( )
| A. | P、S、N | B. | Cl、S、F | C. | S、Cl、O | D. | K、Ca、Na |
17.1mol某烃最多能和2molHCl发生加成反应,生成1mol氯代烷,1mol此氯代烷能和8molCl2发生取代反应,生成只含碳元素和氯元素的氯代烷,该烃可能是( )
| A. | CH3CH=CH2 | B. | CH2=CHCH=CH2 | C. | CH3=CHCH3 | D. | CH3-C≡CH2-CH3 |
14.2015年2月28日,央视原记者柴静及其团队制作的视频《穹顶之下》引起了人们对环境保护的再思考,下列说法体现人与自然和谐相处的是( )
| A. | 将聚氯乙烯等塑料垃圾焚烧 | |
| B. | 推广矿物燃料脱硫技术以减少SO2等有害气体的排放 | |
| C. | 大力开采石油、煤、页岩气(主要成分为CH4)等化石燃料 | |
| D. | 电池使用后随意丢弃,无需处理 |
11.下列溶液中溶质的物质的量浓度为l mol/L的是( )
| A. | 将40 g NaOH固体溶解于1 L水中 | |
| B. | 将22.4 L氯化氢气体溶于水配成l L溶液 | |
| C. | 将l L 10 mol/L的浓盐酸与9 L水混合 | |
| D. | 20 g NaOH固体溶解在水中配成500 mL溶液 |
18.下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
(1)在这10种元素中,非金属性最强的元素是Mg(填“元素符号”),金属性最强的元素是F(填“元素符号”),化学性质最不活泼的元素是Ar(填“元素符号”).
(2)元素①与②中,原子半径较大的是C(填“元素符号”).
(3)元素②与⑦形成的气态氢化物分别是:H2O和H2S(填化学式),两者的热稳定性大小为:前者>后者.(填“>”或“<”).
(4)元素④与⑤的最高价氧化物的水化物的碱性大小为:前者>后者.(填“>”或“<”).
(5)元素⑤的氧化物与盐酸反应的离子方程式为:Al2O3+6H+=2Al3++3H2O.
(6)元素⑤的单质与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+H2O=2NaAlO2+3H2↑.
(7)元素④和⑧形成的化合物的类型(填离子化合物或共价化合物):离子化合物.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑩ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)元素①与②中,原子半径较大的是C(填“元素符号”).
(3)元素②与⑦形成的气态氢化物分别是:H2O和H2S(填化学式),两者的热稳定性大小为:前者>后者.(填“>”或“<”).
(4)元素④与⑤的最高价氧化物的水化物的碱性大小为:前者>后者.(填“>”或“<”).
(5)元素⑤的氧化物与盐酸反应的离子方程式为:Al2O3+6H+=2Al3++3H2O.
(6)元素⑤的单质与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+H2O=2NaAlO2+3H2↑.
(7)元素④和⑧形成的化合物的类型(填离子化合物或共价化合物):离子化合物.
15.下列变化,需要加入适当的氧化剂才能完成的是( )
| A. | PCl3→PCl5 | B. | MnO4-→Mn2+ | C. | SO2→SO32- | D. | FeCl3→FeCl2 |
3.下列化学用语中,书写或说法正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 丙烷的球棍模型为 | |
| C. | 乙醇含有的官能团是-OH,带一个单位负电荷 | |
| D. | 乙酸的分子式为C2H4O2,其中CH3-在溶液中能电离出H+ |