题目内容
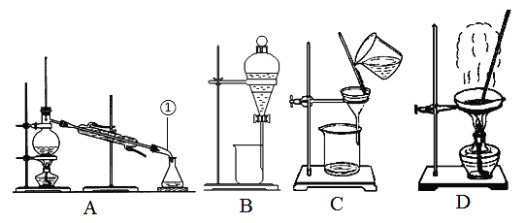
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:

(1)操作①为_____________;操作⑤为____________。
(2)若操作③要除去SO42-,则加入的试剂为_____________;则操作④加入的试剂为_____________。
(3)如何判断SO![]() 已除尽,简述实验操作_____________________;
已除尽,简述实验操作_____________________;
(4)该同学设计的实验方案有一处不合理,理由是_____________________。
【答案】(1)(加水)溶解过滤
(2)Ba(NO3)2K2CO3
(3)取少许滤液,向其中加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽
(4)调节溶液的pH不能用盐酸,而应该用硝酸,否则会引入Cl-
【解析】
试题分析:根据题给实验流程知该提纯操作是将杂质离子转化为沉淀而出去,沉淀反应必须在溶液中进行,操作①为加水溶解;除去SO42-、Mg2+的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的Ba(NO3)2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,过滤,加稀硝酸调节溶液的pH,加热煮沸得硝酸钾溶液。
(1)操作①为加水溶解;操作⑤为分离固液混合物的操作,名称为过滤。
(2)若操作③要除去SO42-,则加入的试剂为Ba(NO3)2;则操作④加入的试剂为K2CO3。
(3)判断SO![]() 已除尽的实验操作为取少许滤液,向其中加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽。
已除尽的实验操作为取少许滤液,向其中加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽。
(4)该同学设计的实验方案的不合理之处为调节溶液的pH不能用盐酸,而应该用硝酸,否则会引入Cl-。

练习册系列答案
相关题目