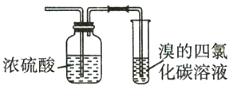
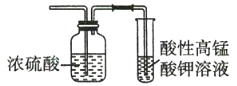
题目内容
【题目】下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是( )
A.CO2B.H2OC.![]() D.CCl4
D.CCl4
【答案】B
【解析】
A.CO2分子中每个O原子和C原子形成两个共用电子对,所以C原子价层电子对个数是2,且不含孤电子对,为直线形结构,VSEPR模型与分子立体结构模型一致,故A错误;
B.水分子中价层电子对个数=2+![]() ×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,故B正确;
×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,故B正确;
C.CO32-的中心原子C原子上含有3个σ 键,中心原子上的孤电子对数=![]() (4+2-2×3)=0,所以CO32-的空间构型是平面三角形,VSEPR模型与分子立体结构模型一致,故C错误;
(4+2-2×3)=0,所以CO32-的空间构型是平面三角形,VSEPR模型与分子立体结构模型一致,故C错误;
D.CCl4分子中中心原子C原子原子价层电子对个数=σ键个数+孤电子对个数=4+![]() (4-1×4)=4,VSEPR模型为正四面体结构,中心原子不含有孤电子对,分子构型为正四面体结构,VSEPR模型与分子立体结构模型一致,故D错误;
(4-1×4)=4,VSEPR模型为正四面体结构,中心原子不含有孤电子对,分子构型为正四面体结构,VSEPR模型与分子立体结构模型一致,故D错误;
故答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】t ℃时,在容积不变的密闭容器中发生反应X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min时浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.平衡后,增大体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
【题目】硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______。
![]() 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______。
(2)工业上以铁硼矿![]() 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量![]() 、FeO、CaO、
、FeO、CaO、![]() 和
和![]() 等
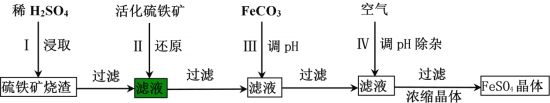
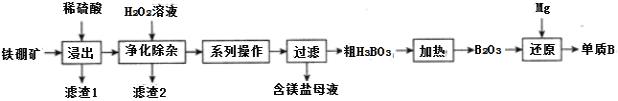
等![]() 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:
已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的pH | 2.7 | 3.1 |
沉淀完全的pH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为______。
“浸出”时,将铁硼矿石粉碎的目的为______。
![]() 滤渣1的主要成分为______。
滤渣1的主要成分为______。
![]() “净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
“净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的![]() 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定![]() 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管,该粗硼样品的纯度为______。
滴定管,该粗硼样品的纯度为______。