题目内容
5.某物质熔融状态可导电,固态可导电,将其投入水中所形成的水溶液也可导电,则可推测该物质可能是( )| A. | 金属单质 | B. | 非金属单质 | C. | 可溶性碱 | D. | 可溶性盐 |
分析 固态可导电,说明存在自由移动的电子,只能是金属晶体,金属在熔融状态可导电,其它晶体不具有此性质.
解答 解:A.金属晶体在熔融状态可导电,固态可导电,并且活泼金属与水反应生成碱,为电解质,溶液也能导电,该金属应为金属单质,故A正确;
B.非金属单质在熔融状态不导电,固态时,石墨可导电,故B错误;
C.可溶性碱在固态时不能电离出自由移动的离子,固态时不导电,故C错误;
D.可溶性盐属于离子化合物,在固态时不能电离出自由移动的离子,固态时不导电,故D错误.
故选A.
点评 本题考查晶体的导电性,注意把握不同晶体的性质,学习中注意相关基础知识的积累,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
15.N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)?4NO2(g)+O2(g)△H>0,T1温度下的部分实验数据为下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
16.下列属于微量元素的是( )
| A. | 铁 | B. | 氧 | C. | 钾 | D. | 钙 |
10.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测得该物质属于离子化合物,且具有良好的超导性,下列关于K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性键 | |
| B. | K3C60中含有非极性共价键 | |
| C. | 1 mol K3C60中含有的阴离子个数为3×6.02×1023 | |
| D. | 该物质的化学式可写成KC20 |
14.下列各能层中不包含p能级的是( )
| A. | N | B. | M | C. | L | D. | K |
15.用如图装置进行实验,将液体A逐渐加入到固体B中,下列叙述正确的是( )
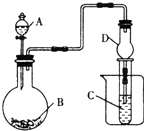

| A. | 若A为浓盐酸,B为KMnO4(KMnO4在常温下能与浓盐酸反应),C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为硫酸,B为大理石,C中盛澄清石灰水,则C中溶液先出现浑浊后变澄清 | |
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀溶解 | |
| D. | 上述实验中仪器D可以用长玻璃导管代替 |

 .
.