题目内容
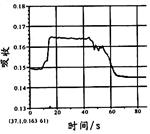
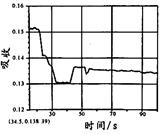
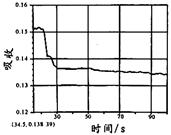
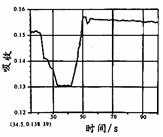
在密闭容器中存在如下反应:A (g)+3B(g) 2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

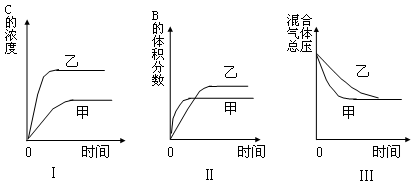
下列判断一定错误的是


下列判断一定错误的是
| A.图Ⅰ研究的是压强对反应的影响,且乙的压强较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用催化剂的效率较高 |
C
试题分析:增大压强,化学反应速率增大,达到平衡的时间缩短,且平衡向右移动。故A、B正确;升高温度化学反应速率加快,平衡向左移动,B的体积分数增大,故C错;催化剂可以改变化学反应的速率,对平衡没有影响,D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (H2O)x(g),反应物和生成物的物质的量随时间变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间变化关系如图。下列说法不正确的是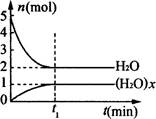
 2C(g) ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
2C(g) ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )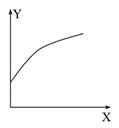
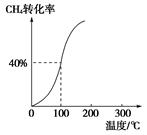
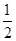 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。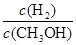 减小
减小 CO(g)+2H2(g),此反应能自发进行的原因是:___。
CO(g)+2H2(g),此反应能自发进行的原因是:___。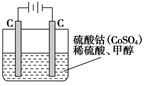
 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )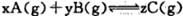 平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是 SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )
SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )