题目内容
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0 kJ/mol
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。
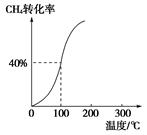
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________;
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将1.0 mol CO与2.0 mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的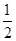 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是:___。
CO(g)+2H2(g),此反应能自发进行的原因是:___。
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
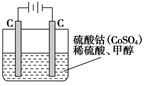
①写出阳极电极反应式_______________;
②写出除去甲醇的离子方程式___________________。
Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0 kJ/mol
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________;
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将1.0 mol CO与2.0 mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的
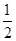 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。| A.c(H2)减小 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 |
D.重新平衡时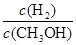 减小 减小 |
(4)工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)
 CO(g)+2H2(g),此反应能自发进行的原因是:___。
CO(g)+2H2(g),此反应能自发进行的原因是:___。(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

①写出阳极电极反应式_______________;
②写出除去甲醇的离子方程式___________________。
(1)CH4(g)+H2O(g) CH3OH(g)+H2(g)ΔH=+77.0 kJ·mol-1
CH3OH(g)+H2(g)ΔH=+77.0 kJ·mol-1
(2)①0.0024 mol·L-1·min-1 ②7.2×10-5
(3)CD
(4)该反应是一个熵增的反应(ΔS>0)
(5)①Co2+-e-=Co3+ ②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
 CH3OH(g)+H2(g)ΔH=+77.0 kJ·mol-1
CH3OH(g)+H2(g)ΔH=+77.0 kJ·mol-1(2)①0.0024 mol·L-1·min-1 ②7.2×10-5
(3)CD
(4)该反应是一个熵增的反应(ΔS>0)
(5)①Co2+-e-=Co3+ ②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
(1)根据盖斯定律,将两个已知的热化学方程式相加可得:CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1。
(2)v(H2)=3v(CH4)=3× =0.0024 mol·L-1·min-1。根据三段式:
=0.0024 mol·L-1·min-1。根据三段式:
CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol/L) 0.01 0.02 0 0
转化(mol/L) 0.004 0.004 0.004 0.012
平衡(mol/L) 0.006 0.016 0.004 0.012
则平衡常数:K=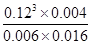 =7.2×10-5。
=7.2×10-5。
(3)增大压强,平衡向正反应方向移动,C、D项正确;但移动的结果不会抵消条件的改变,故c(H2)仍然增大,A项错误;增大压强正逆反应速率均增大,B项错误;平衡常数只与温度有关,温度不变平衡常数不变,E项错误。
(5)Co2+在阳极失电子生成Co3+。
(2)v(H2)=3v(CH4)=3×
 =0.0024 mol·L-1·min-1。根据三段式:
=0.0024 mol·L-1·min-1。根据三段式:CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)起始(mol/L) 0.01 0.02 0 0
转化(mol/L) 0.004 0.004 0.004 0.012
平衡(mol/L) 0.006 0.016 0.004 0.012
则平衡常数:K=
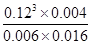 =7.2×10-5。
=7.2×10-5。(3)增大压强,平衡向正反应方向移动,C、D项正确;但移动的结果不会抵消条件的改变,故c(H2)仍然增大,A项错误;增大压强正逆反应速率均增大,B项错误;平衡常数只与温度有关,温度不变平衡常数不变,E项错误。
(5)Co2+在阳极失电子生成Co3+。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
 2C(g)达到平衡的标志是( )。
2C(g)达到平衡的标志是( )。 H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
 N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是( )
N2O4 (g) △H<0。一段时间后相继达到平衡状态。下列说法中正确的是( )
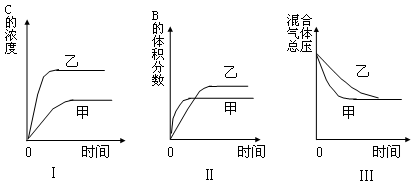
 2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( ) )
)
 CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则: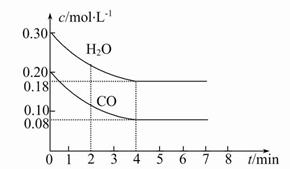
 2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表: