题目内容
在图1所示密闭容器中充满红棕色的NO2气体,当迅速将活塞向右推一段距离后保持活塞不动时,色度计测出颜色变化的情况如图2所示。如果迅速将活塞往左拉一段距离后保持活塞不动时,色度计测出颜色变化的情况正确的图示为

图1 图2

图1 图2
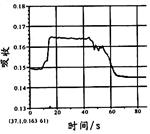 | 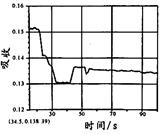 | 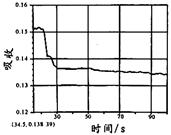 | 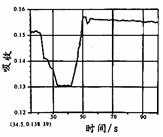 |
| A. | B. | C. | D. |
B
试题分析:容器中发生发生2NO2(g)
 N2O4(g),反应达到平衡后将活塞迅速左拉的过程中,各个组分浓度会因为体积的增加而导致浓度降低,气体颜色变浅,但是压强减小,化学平衡还会向左进行,混合气体的颜色会逐渐变深,但是也比拉活塞前浅,故B正确。
N2O4(g),反应达到平衡后将活塞迅速左拉的过程中,各个组分浓度会因为体积的增加而导致浓度降低,气体颜色变浅,但是压强减小,化学平衡还会向左进行,混合气体的颜色会逐渐变深,但是也比拉活塞前浅,故B正确。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

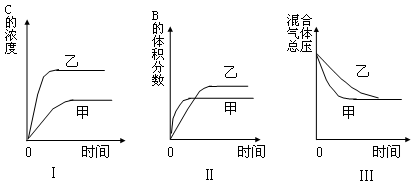
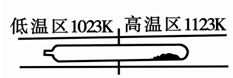
 2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表: CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答: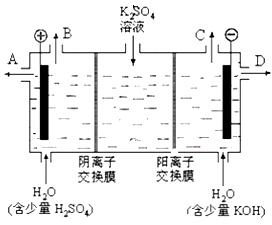
 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( ) CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1 2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是
2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是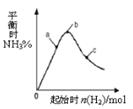
 pC(g)+qD(g) △H<0。下列结论中错误的是
pC(g)+qD(g) △H<0。下列结论中错误的是