题目内容
一定温度下,将NO2与SO2以体积比1∶2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )
SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )
 SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )
SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )| A.平衡常数K= |
| B.达到平衡后NO2与SO2的转化率相等 |
| C.SO3和NO的体积比保持不变可以证明达到平衡状态 |
| D.在反应过程中可能存在c(NO2)=c(SO2) |
A
设NO2初始浓度为1 mol·L-1,依据“三部曲”计算
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
始态(mol·L-1): 1 2 0 0
反应(mol·L-1): x x x x
终态(mol·L-1): 1-x 2-x x x
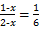 ,解得x=0.8,K=
,解得x=0.8,K= ,A选项正确;NO2与SO2的转化率应为2∶1,B错误;SO3与NO的体积不论平衡与否,均为1∶1,C错误;依据c(NO2)="(1-x)" mol、c(SO2)="(2-x)" mol可知D选项错误
,A选项正确;NO2与SO2的转化率应为2∶1,B错误;SO3与NO的体积不论平衡与否,均为1∶1,C错误;依据c(NO2)="(1-x)" mol、c(SO2)="(2-x)" mol可知D选项错误
NO2(g)+SO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)始态(mol·L-1): 1 2 0 0
反应(mol·L-1): x x x x
终态(mol·L-1): 1-x 2-x x x
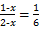 ,解得x=0.8,K=
,解得x=0.8,K= ,A选项正确;NO2与SO2的转化率应为2∶1,B错误;SO3与NO的体积不论平衡与否,均为1∶1,C错误;依据c(NO2)="(1-x)" mol、c(SO2)="(2-x)" mol可知D选项错误
,A选项正确;NO2与SO2的转化率应为2∶1,B错误;SO3与NO的体积不论平衡与否,均为1∶1,C错误;依据c(NO2)="(1-x)" mol、c(SO2)="(2-x)" mol可知D选项错误
练习册系列答案
相关题目
 H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。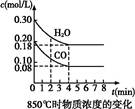

 CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则: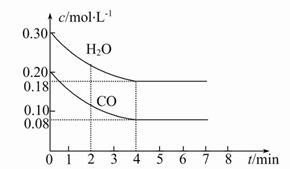
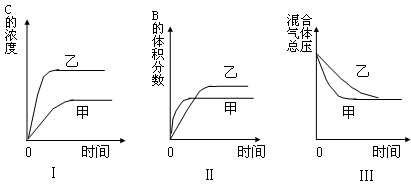
 C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )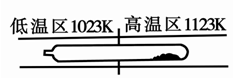
 2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:
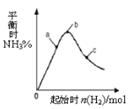
2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表: 2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是
2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是