题目内容
16.下列说法中正确的是( )| A. | 金属与非金属化合时,都可以形成离子键 | |
| B. | 电负性相差越大的元素原子间越容易形成共价键 | |
| C. | 若元素原子核外电子数为a,则其核外共有a种不同运动状态的电子 | |
| D. | 同周期主族元素从左到右,第一电离能和电负性均依次增大 |
分析 A.金属和非金属化合时,可能形成共价键;
B.电负性相差越大的元素原子间越容易形成离子键;
C.原子核外没有子运动状态完全相同的电子;
D.同周期主族元素ⅤA族第一电离能大于ⅥA族.
解答 解:A.金属和非金属化合时,可能形成共价键,如氯化铝,故A错误;
B.电负性相差越大的元素原子间越容易形成离子键,存在电离的得失,形成离子化合物,故B错误;
C.原子核外不同轨道的电子不同,同一轨道的电子的自旋方向不同,则没有子运动状态完全相同的电子,故C正确;
D.同周期主族元素ⅤA族第一电离能大于ⅥA族,故D错误.
故选C.
点评 本题考查较为综合,涉及化合物和化学键的关系、原子核外电子排布以及元素周期率知识,为高频考点,根据物质的构成微粒确定化学键,注意化学键的概念中是“相互作用”而不是引力或排斥力,为易错点.

练习册系列答案
相关题目
6.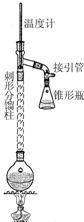 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
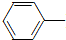 NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$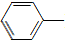 NHCOCH3+H2O
NHCOCH3+H2O
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
实验步骤如下:
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下: NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$ NHCOCH3+H2O
NHCOCH3+H2O已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4 | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
7.已知丙烷的二氯代物有四种同分异构体,则其六氯代物的同分异构体数目有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
4.某有机物的结构简式如图所示,关于该有机物的说法不正确的是( )
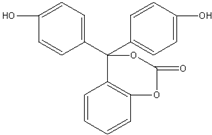

| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成、取代、氧化、消去等反应 | |
| D. | 1mol该有机物与足量NaOH 溶液充分反应,消耗NaOH的物质的量为5 mol |
11.反应下列原子或离子核外电子未成对电子数最多的是( )
| A. | N | B. | Ni | C. | Cr | D. | Cu+ |
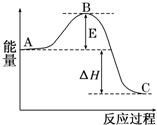 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.