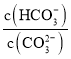题目内容
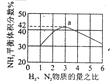
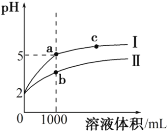
【题目】常温下,向10mL0.1000 molL-1的H2A溶液中,逐滴滴加0.1000 molL-1的NaOH 溶液,混合溶液PH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
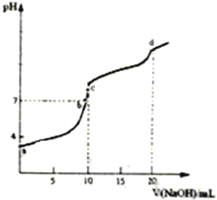
A.在a、b、c、d 四点中,由水电离出的c(H+)·c(OH-)不变
B.b点溶液存在关系:c(OH-)=c(H+)+c(H2A)-c(A2-)
C.C 点溶液中:c(Na+)>c(HA-)>c(OH-)>c(H2A)> c(H+)>c(A2-)
D.d 点溶液中: 2c(Na+)=c(HA-)+ C(A2-)+ c(H2A)
【答案】C
【解析】
A.在a、b、c、d四点中溶液的pH逐渐升高,水电离出的离子浓度均不相同,所以水电离出的c(H+)和c(OH-)的乘积是变化的,任何溶液中存在H+的总浓度和OH-总浓度乘积不变,而不是只水电离的,故A错误;
B.b点为pH=7的点,c(OH-)=c(H+)相等,所以B错;
C.c点溶质为NaHA,溶液中存在三个平衡:HA- H+ +A2-、HA- +H2OH2A+OH-、H2OH+ +OH-,溶液显碱性,则HA-水解大于电离,所以c(H2A)>c(A2-)、c(OH-)>c(H+),又H+ 和OH-又来自于水的电离,则c(OH-)>c(H2A),c(H+)>c(A2-),故c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-),C正确;
D.d点溶质为Na2A,物料守恒为c(Na+)=2c(HA-)+2c(A2-)+2c(H2A),故D错误;
选C。

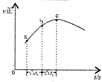
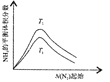
【题目】根据工业上合成氨的反应为:![]() ,判断下列错误的是
,判断下列错误的是
A | B | C | D |
|
|
|
|
根据图中a点数据计算 | 表示从通入原料开始,随温度不断升高, | 向绝热恒容器中通入 | 图中 |
A.AB.BC.CD.D