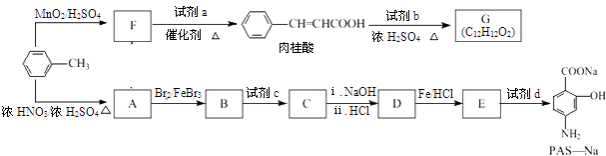
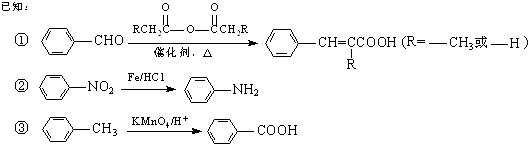
题目内容
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。下列说法正确的是

A. Y、Z、W处于同一周期
B. X、Y、Z、W的原子序数递增
C. X、W可形成化学式为XW的离子化合物
D. 简单离子半径是Z小于W
【答案】B
【解析】X、Y、Z、W是四种短周期主族元素,因同周期元素随着原子序数的增大而原子半径逐渐减小,Y、Z两种元素的单质是空气主要成分,分别为氧气、氮气,可知Y为N元素,Z为O元素。X的原子半径最小,因此X位于第一周期,应为H元素,Y、Z为第二周期,W为第三周期,W原子最外层电子数与Ne原子最外层电子数相差1,应为Cl元素,A.由以上分析可知Y、Z为第二周期,W为第三周期,A错误;B.X、Y、Z、W分别是H、N、O、Cl,原子序数递增,B正确;C.X与W形成的共价化合物HCl,C错误;D.氧离子半径小于氯离子半径,D错误;答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 | 装置 |
A | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: N>C>Si |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡益均可以生成白色沉淀 | |
D | 浓硝酸 | 铝片 | 氢氧化钠溶液 | 浓硝酸具有强氧化性 |
A. A B. B C. C D. D
【题目】已知A,B,C,D,E,F,G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如表所示.
元素 | 原子结构特征或有关物质的性质 |
A | 原子的最外层电子数是其内层电子数的2倍 |
B | 其单质是空气中含量最多的物质 |
C | 原子的最外层电子数是其电子层数的4倍 |
D | 位于第ⅡA族,其原子半径比E的大 |
E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
F | 原子序数16,其单质在通常状况下为固体 |
G | 原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是 . 这七种元素中,不属于主族元素的元素的名称是 .
(2)在E,F,G三种元素中,原子半径最小的是(填元素符号).
(3)元素A与G可形成化合物AG4 , 在该化合物中含有的化学键类型为 , 分子的空间结构为 . A与氧元素可形成化合物AO2 , 该化合物分子的电子式为 .
(4)元素B能与氢元素形成化合物BH3 , 在通常状况下,BH3的水溶液呈(填“酸”、“碱”或“中”)性,原因为(用方程式表示)