题目内容
13.下列各组离子在指定条件下一定能大量共存的是( )| A. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:Na+、CO32-、NO3-、AlO2- | |
| C. | 无色溶液中:K+、AlO2-、HCO3-、Cr2O72- | |
| D. | pH=1的溶液中:Na+、Al3+、NO3-、S2O32- |
分析 A.加入苯酚显紫色的溶液中存在铁离子,铁离子能够氧化碘离子;
B.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.Cr2O72-为有色离子,碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀;
D.pH=1的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化硫代硫酸根离子;硫代硫酸根离子能够与氢离子反应.
解答 解:A.加入苯酚显紫色的溶液中存在Fe3+,Fe3+能够氧化I-,在溶液中不能大量共存,故A错误;
B.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中存在大量氢氧根离子,Na+、CO32-、NO3-、AlO2-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.Cr2O72-为有色离子,HCO3-的酸性大于氢氧化铝,HCO3-与AlO2-反应生成氢氧化铝,在溶液中不能大量共存,故C错误;
D.该溶液为酸性溶液,NO3-、S2O32-在酸性溶液中发生氧化还原反应,S2O32-与氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CHCl3>H2O>己烷 | |
| C. | 氢元素质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 等质量物质完全燃烧耗O2量:苯>环已烷>已烷 |
| A. | 肥皂是高级脂肪酸与甘油的酯化产物 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 | |
| D. | 石油裂解和油脂皂化都有高分子生成小分子的过程 |
| A. | 在动力、设备、材料允许的条件下尽可能在高压下进行 | |
| B. | 温度越高越有利于工业合成氨 | |
| C. | 在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本 | |
| D. | 及时从反应体系中分离出氨气有利于平衡向正反应方向移动 |
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
| A. | 单位时间内生成n mol B,同时消耗3n mol C | |
| B. | 容器内压强不随时间而变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | 单位时间内生成2n mol A,同时生成n mol D |
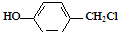 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 ;
; ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 ;
;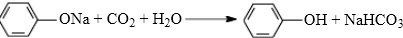 .
.