题目内容
【题目】K2SO4是制备K2CO3、KAl(SO4)2等钾盐的原料,可用于玻璃、染料、香料等工业,在医药上可用作缓泻剂,在农业上是主要的无氯钾肥。以下是用氨碱法从明矾石提取硫酸钾工艺流程图。明矾石主要成分为K2SO4Al2(SO4)34Al(OH)3 ,通常含有少量SiO2、Fe2O3等。

回答题:
(1)用28%氨水(密度为0.898g/L)配制4%氨水(密度为0.981g/L)500mL,需28%氨水______mL,配制溶液时,应选用的仪器是______(选填序号)。
(a)20mL量筒 (b)100 mL量筒 (c)500 mL量筒 (d) 500 mL容量瓶
(2)填写下列操作名称:操作Ⅰ_________、操作Ⅱ_________、操作Ⅲ_________。
(3)硅渣主要成分是___________,(写化学式),脱硅后的固体为红泥,可用于_________。
(4)上述流程中可以循环使用的物质X是__________________。
(5)钾氮肥的主要成分是__________,请设计实验检验钾氮肥中(除K+以外)的阳离子:(写出所需试剂、实验步骤和结论)_________________;
(6)为了测定钾氮肥中钾的含量,在试样完全溶于水后,加入足量氯化钡溶液,得到白色沉淀a克,若要计算K2SO4的物质的量,还需要_____________数据,列出计算式:_____________________。
【答案】 78.0 b 过滤 结晶 加热 SiO2 Fe2O3 炼铁(作颜料) NaOH K2SO4、(NH4)2SO4 取少量样品溶于水,加入氢氧化钠溶液加热,用湿润的红色石蕊试纸检验,试纸变红,则证明有NH4+。 钾氮肥的主要成分的质量
设硫酸钾物质的量为X,硫酸铵物质的量为Y
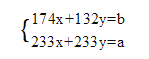
【解析】脱水后加入氨水,铝离子转化为氢氧化铝沉淀,过滤后向滤液中加入硫酸中和氨水,结晶得到钾氮肥;氨渣中含有氧化铝、二氧化硅和氧化铁,加入氢氧化钠,氧化铝溶解得到偏铝酸钠溶液,然后水解转化为氢氧化铝沉淀和氢氧化钠,氢氧化铝分解得到氧化铝,据此分析解答。
(1)稀释过程中溶质不变,则需28%氨水![]() ,应选用的仪器是100 mL量筒,答案选b;(2)填写下列操作名称:氨水溶解后,有不溶物存在,因此操作Ⅰ是过滤;从溶液中得到钾氮肥,需要结晶;氢氧化铝分解得到氧化铝,所以操作Ⅲ是加热;(3)二氧化硅、氧化铁不溶于氢氧化钠,所以硅渣主要成分是SiO2、Fe2O3,因此脱硅后的固体可用于炼铁(作颜料)。(4)偏铝酸钠水解得到氢氧化钠,则上述流程中可以循环使用的物质X是NaOH。(5)钾氮肥的主要成分是K2SO4、(NH4)2SO4。铵根能与强碱反应产生碱性气体氨气,则检验铵根的实验操作为:取少量样品溶于水,加入氢氧化钠溶液加热,用湿润的红色石蕊试纸检验,试纸变红,则证明有NH4+。(6)为了测定钾氮肥中钾的含量,在试样完全溶于水后,加入足量氯化钡溶液,得到白色沉淀a克,白色沉淀是硫酸钡,所以若要计算K2SO4的物质的量,还需要钾氮肥的主要成分的质量;设钾氮肥的质量是bg,硫酸钾物质的量为xmol,硫酸铵物质的量为xmol,则174x+132y=b、233x+233y=a。
,应选用的仪器是100 mL量筒,答案选b;(2)填写下列操作名称:氨水溶解后,有不溶物存在,因此操作Ⅰ是过滤;从溶液中得到钾氮肥,需要结晶;氢氧化铝分解得到氧化铝,所以操作Ⅲ是加热;(3)二氧化硅、氧化铁不溶于氢氧化钠,所以硅渣主要成分是SiO2、Fe2O3,因此脱硅后的固体可用于炼铁(作颜料)。(4)偏铝酸钠水解得到氢氧化钠,则上述流程中可以循环使用的物质X是NaOH。(5)钾氮肥的主要成分是K2SO4、(NH4)2SO4。铵根能与强碱反应产生碱性气体氨气,则检验铵根的实验操作为:取少量样品溶于水,加入氢氧化钠溶液加热,用湿润的红色石蕊试纸检验,试纸变红,则证明有NH4+。(6)为了测定钾氮肥中钾的含量,在试样完全溶于水后,加入足量氯化钡溶液,得到白色沉淀a克,白色沉淀是硫酸钡,所以若要计算K2SO4的物质的量,还需要钾氮肥的主要成分的质量;设钾氮肥的质量是bg,硫酸钾物质的量为xmol,硫酸铵物质的量为xmol,则174x+132y=b、233x+233y=a。

【题目】工业上制取CuCl2的生产流程如下:
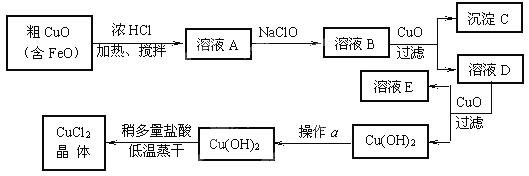
请结合下表数据,回答下列问题:
物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O)
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和__________________、_________________。
(2)操作I为____________________操作Ⅱ为________________
(3)方案I中如何判别加入的氯化钡已经过量_____________在方案Ⅱ中滴定终点的判断方法是________________。
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为______________。(写成分数形式)有同学模仿方案I,提出方案Ⅲ:取25.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
(5)根据方案Ⅲ,从理论上讲,下列说法正确的是________(填序号)
a. 方案I比方案Ⅲ的计算结果要低
b. 方案I比方案Ⅲ的计算结果要高
c. m1=m2 ,方案I和方案Ⅲ的结果一样
d. 方案Ⅲ不应根据方案I的方法计算
(6)上述实验中,由于操作错误所引起的实验误差分析正确的是__________(填序号)。
a. 方案I中如果没有洗涤操作,实验结果将偏小
b. 方案I中如果没有操作Ⅱ,实验结果将偏大
c. 方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d. 方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大