题目内容
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O)
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和__________________、_________________。
(2)操作I为____________________操作Ⅱ为________________
(3)方案I中如何判别加入的氯化钡已经过量_____________在方案Ⅱ中滴定终点的判断方法是________________。
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为______________。(写成分数形式)有同学模仿方案I,提出方案Ⅲ:取25.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
(5)根据方案Ⅲ,从理论上讲,下列说法正确的是________(填序号)
a. 方案I比方案Ⅲ的计算结果要低
b. 方案I比方案Ⅲ的计算结果要高
c. m1=m2 ,方案I和方案Ⅲ的结果一样
d. 方案Ⅲ不应根据方案I的方法计算
(6)上述实验中,由于操作错误所引起的实验误差分析正确的是__________(填序号)。
a. 方案I中如果没有洗涤操作,实验结果将偏小
b. 方案I中如果没有操作Ⅱ,实验结果将偏大
c. 方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d. 方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大
【答案】 电子天平 250mL的容量瓶 过滤 干燥(烘干) 静置分层后,向上清液中加入盐酸酸化的氯化钡,不再产生沉淀,即已沉淀完全 加入最后一滴后溶液由无色变为紫色,且在半分钟内不褪 1323a÷20W×100% bd ad
【解析】(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和电子天平、250mL的容量瓶。(2)加入氯化钡产生白色沉淀,因此操作I为过滤;沉淀洗涤后称量前需要干燥,即操作Ⅱ为干燥(烘干);(3)根据硫酸钡是不溶于水也不溶于酸的白色沉淀判断方案I中加入的氯化钡已经过量,即;静置分层后,向上清液中加入盐酸酸化的氯化钡,不再产生沉淀,即已沉淀完全;酸性高锰酸钾溶液显紫红色,则在方案Ⅱ中滴定终点的判断方法是加入最后一滴后溶液由无色变为紫色,且在半分钟内不褪。(4)四次实验消耗标准液体积分别是(mL)20.95、21.00、20.05、21.05,显然第三次数据误差较大,舍去,则其平均值是21.00mL,根据方程式可知25mL溶液中亚硫酸钠的物质的量是2.5×0.021L×amol/L=0.0525amol,实验亚硫酸钠的纯度是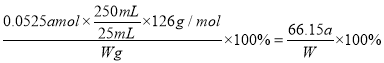 。(5)a.酸性溶液中硝酸根具有强氧化性,能把亚硫酸钠氧化为硫酸钠,因此方案I比方案Ⅲ的计算结果要高,a错误;b.方案I比方案Ⅲ的计算结果要高,b正确;c.方案Ⅲ中S元素全部转化为硫酸钡,因此方案I和方案Ⅲ的结果不可能一样,c错误;d.方案Ⅲ中S元素全部转化为硫酸钡,因此方案Ⅲ不应根据方案I的方法计算,d正确,答案选bd;(6)a.方案I中如果没有洗涤操作,则硫酸钡质量增加,所以实验结果将偏小,a正确;b.方案I中如果没有操作Ⅱ,即没有干燥,则硫酸钡质量增加,所以实验结果将偏小,b错误;c.方案Ⅲ中如果没有洗涤操作,硫酸钡质量增加,实验结果将偏大,c错误;d.方案Ⅲ中如果没有操作Ⅱ,硫酸钡质量增加,实验结果将偏大,d正确,答案选ad。
。(5)a.酸性溶液中硝酸根具有强氧化性,能把亚硫酸钠氧化为硫酸钠,因此方案I比方案Ⅲ的计算结果要高,a错误;b.方案I比方案Ⅲ的计算结果要高,b正确;c.方案Ⅲ中S元素全部转化为硫酸钡,因此方案I和方案Ⅲ的结果不可能一样,c错误;d.方案Ⅲ中S元素全部转化为硫酸钡,因此方案Ⅲ不应根据方案I的方法计算,d正确,答案选bd;(6)a.方案I中如果没有洗涤操作,则硫酸钡质量增加,所以实验结果将偏小,a正确;b.方案I中如果没有操作Ⅱ,即没有干燥,则硫酸钡质量增加,所以实验结果将偏小,b错误;c.方案Ⅲ中如果没有洗涤操作,硫酸钡质量增加,实验结果将偏大,c错误;d.方案Ⅲ中如果没有操作Ⅱ,硫酸钡质量增加,实验结果将偏大,d正确,答案选ad。

【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,判断滴定终点的现象是__________________。
(2)下列操作中可能使所测NaOH溶液的浓度偏低的是______。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
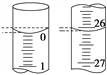
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.31 | 26.31 |
第二次 | 25.00 | 1.56 | a | 28.74 |
第三次 | 25.00 | 0.22 | 26.51 | b |
表格中a的数值为_________, b的数值为_________。
依据上表数据列式计算该NaOH溶液的物质的量浓度为________________。
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
