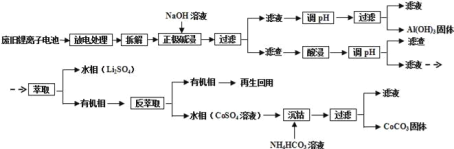
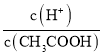题目内容
【题目】FeCl3具有净水作用,而高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,处理污水比FeCl3高效。请回答下列问题:已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3
(1)FeCl3净水的原理是______。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为______(填写数值)。
(2)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=______molL-1。
(3)FeCl3在溶液中分三步水解:
Fe3++H2OFe(OH)2++H+ K1
Fe(OH)2++H2O![]() +H+ K2
+H+ K2
![]() +H2OFe(OH)3+H+ K3
+H2OFe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_________。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() +yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
a.降温 b.加水稀释 c. 加入NaHCO3d.加入NH4Cl
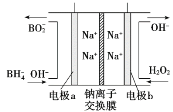
(4)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图所示:
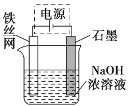
①电解过程中阳极的电极反应式为______。
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图所示。电极a与甲池中_______(填“石墨”或“铁丝网”)连接,电极b的反应式为________。
【答案】Fe3++3H2OFe(OH)3(胶体)+3H+ 2.5×10-5 4×10-5 K1>K2>K3 b c Fe+8OH--6e-=![]() +4H2O 石墨 H2O2+2e-=2OH-
+4H2O 石墨 H2O2+2e-=2OH-
【解析】
(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+,该反应平衡常数K=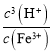 =
=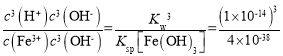 =2.5×10-5;
=2.5×10-5;
(2)25℃时pH=3的溶液中,c(H+)=10-3mol/L,则c(OHˉ)=10-11mol/L,c(Fe3+)=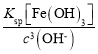 =
=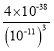 mol/L=4×10-5 mol/L;
mol/L=4×10-5 mol/L;
(3)由于前一步的水解会对后一步的水解产生抑制作用,所以三级水解程度依次减小,即K1>K2>K3;
a.水解为吸热反应,降温平衡逆向移动,故a不符合;
b.“越稀越水解”,加水稀释可以使平衡正向移动,故b符合;
c.加入碳酸氢钠,电离出的碳酸氢根与氢离子结合促进铁离子的水解,故c符合;
d.铵根水解产生氢离子,会使平衡逆向移动,故d不符合;
综上所述选bc;
(4)①铁丝网与电源正极相连为阳极,根据题意可知Fe失电子被氧化成![]() ,所以电极反应式为Fe+8OH--6e-=
,所以电极反应式为Fe+8OH--6e-=![]() +4H2O;
+4H2O;
②据图可知电极b上H2O2转化为OHˉ,O元素被还原,所以b电极为电池的正极,电极反应为H2O2+2e-=2OH-,电极a为电池负极,与甲池中的石墨连接。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.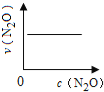 B.
B.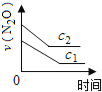 C.
C.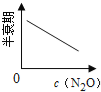 D.
D.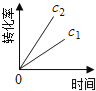
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
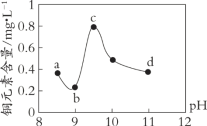
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升