题目内容
【题目】随Cr含量的变化三种稀酸对Fe﹣Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
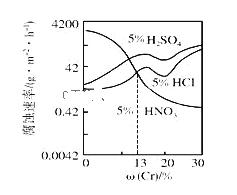
A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.酸对Fe﹣Cr合金的腐蚀与阴离子浓度无关
【答案】B
【解析】
根据图中的纵横坐标可知,横坐标为Cr含量,纵坐标为金属被腐蚀的反应速率,由图中的曲线变化,硝酸对合金的腐蚀速率随Cr含量增加而变小,硫酸和盐酸对金属的腐蚀速率随Cr含量增加而变大,但随着Cr含量增加变化趋势变慢,则腐蚀性减弱.
A. 由图可知,铬的含量大于13%时,稀硝酸对合金的腐蚀速率比盐酸、硫酸弱,小于13%强,故A错误;
B. 由图象可知,随着Cr含量增加,稀硝酸对FeCr合金的腐蚀性减弱,故B正确;
C. 不能解释盐酸、硝酸氢离子浓度相等,但硝酸腐蚀速度慢,故C错误;
D. 盐酸、硝酸的阳离子相同阴离子不同,可说明酸对FeCr合金的腐蚀与阴离子浓度有关,故D错误。
故选B。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】某化学兴趣小组的同学利用酸碱滴定法测定某变质烧碱样品(含Na2CO3杂质)中 NaOH 的质量分数。实验步骤如下:
(I)迅速地称取烧碱样品0.50 g,溶解后配制成100 mL溶液,备用。
(II)将0.1000 mol·L1HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取 20.00mL 样品溶液于锥形瓶中,滴加 2 滴酚酞;以HCl 标准溶液滴定至第一终点,记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用 HCl 标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
实验序号 | 1 | 2 | 3 |
V0/ mL | 0.00 | 0.00 | 0.00 |
V1/ mL | 22.22 | 22.18 | 22.20 |
V2/ mL | 23.72 | 23.68 | 23.70 |
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和__。酸式滴定管用蒸馏水洗净后、装入标准溶液并调零之前,应进行的操作是__。
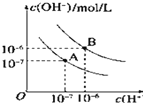
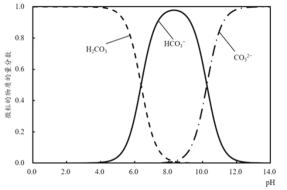
(2)溶液中的H2CO3、![]() 、
、![]() 的物质的量分数随 pH 的变化如图所示:
的物质的量分数随 pH 的变化如图所示:
酚酞和甲基橙指示剂的变色pH范围及对应颜色见表。
酚酞 | 无色 pH < 8.0 | 粉红 pH 8.0~9.8 | 红 pH > 9.8 |
甲基橙 | 红 pH < 3.1 | 橙 pH 3.1~4.4 | 黄 pH > 4.4 |
①滴定至第一终点时,溶液中含碳微粒的主要存在形式为__。
②滴定至第一终点的过程中,发生反应的离子方程式为__。
③已知:pKa1= lgKa1,结合图像可知,H2CO3的pKa1约为__。
a.5.0 b.6.4 c.8.0 d.10.3
(3)下列有关滴定的说法正确的是__。
a.滴定至第一终点时,溶液中 c(H+)+c(Na+) = 2c(![]() ) + c(
) + c(![]() ) + c(OH)
) + c(OH)
b.滴定至第一终点时,溶液中 n(Cl) +n(![]() ) + n(
) + n(![]() ) + n(H2CO3) =n(Na+)
) + n(H2CO3) =n(Na+)
c.判断滴定至第二终点的现象是溶液由黄色变为橙色
d.记录酸式滴定管读数V1时,俯视标准液液面,会导致测得的NaOH质量分数偏低
(4)样品中NaOH的质量分数![]() (NaOH) =__%(计算结果保留小数点后 1 位)
(NaOH) =__%(计算结果保留小数点后 1 位)
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)戊装置中冷凝管的进水口为___________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为________________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________________。
(4)如果缺少乙装置,可能产生的后果是___________________;己装置的作用是__________________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 C.溴水 d.AgNO3溶液
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38 gSnCl4,则SnCl4的产率为____________________。